МИКРОБИОТА ВЛАГАЛИЩА #13
Проф. Маркку Воутилайнен (Markku Voutilainen)
Медицинский факультет Университета Турку; Университетская больница Турку, отделение гастроэнтерологии, Турку, Финляндия


Проф. Маркку Воутилайнен (Markku Voutilainen)
Медицинский факультет Университета Турку; Университетская больница Турку, отделение гастроэнтерологии, Турку, Финляндия

Благодаря рекомбинантным эндолизинам типа 1,4-бета-N-ацетилмурамидазы, получаемым с помощью профагов Gardnerella, можно удалить бактериальную биопленку, ответственную за развитие бактериального вагиноза, не повреждая полезные бактерии микробиоты влагалища.
С помощью метода перестановки доменов ученые создали ряд биоинженерных эндолизинов (ферментов бактериофагов), способных разрушать бактериальные стенки. Затем они сравнили их бактерицидную активность в отношении штаммов Gardnerella с активностью эндолизинов дикого типа. Бактерицидная активность рекомбинантных эндолизинов в 10 раз превышала активность любого фермента дикого типа. В анализе на панели из 20 штаммов 4 видов Gardnerella (G. vaginalis, G. leopoldii, G. piotii и G. swidsinski) эндолизин PM-477 показал самую высокую эффективность по сравнению с контрольными антибиотиками (метронидазол, тинидазол, клиндамицин). Более того, PM-477 не влиял на полезные лактобактерии и другие виды вагинальных бактерий. По мнению авторов, PM-477 обладает высокой селективностью по отношению к Gardnerella и убивает штаммы каждого из четырех основных видов, не влияя на полезные лактобациллы и другие виды, типичные для микробиоты влагалища. Эффект PM-477 был подтвержден результатами микроскопии в смешанных культурах Gardnerella и lactobacilli. Чтобы проанализировать эффективность PM-477 в условиях, близких к in vivo, исследователи обработали им вагинальные мазки от 15 пациенток с бактериальным вагинозом и проанализировали их с помощью флуоресцентной гибридизации in situ (FISH). В 13 из 15 случаев PM-477 уничтожил все виды Gardnerella и физически растворил биопленки, не воздействуя при этом на микробиоту влагалища. Авторы сделали вывод, что эндолизины могут стать перспективной альтернативой антибиотикам при лечении бактериального вагиноза....
Проф. Маркку Воутилайнен (Markku Voutilainen)
Медицинский факультет Университета Турку; Университетская больница Турку, отделение гастроэнтерологии, Турку, Финляндия

Есть основания полагать, что сердечно-сосудистые заболевания (ССЗ) и сахарный диабет 2 типа (СД2) отчасти могут быть связаны с индивидуальными особенностями микробиома кишечника, которые влияют на метаболизм и функционирование иммунной системы. В то время как в доклинических исследованиях показано, что микробиом кишечника и питание влияют друг на друга, надежные клинические доказательства этого, особенно в свете риска развития кардиометаболических заболеваний, все еще отсутствуют.
Цель исследования заключалась в изучении связи между средиземноморской диетой (MedDiet), микробиомом кишечника и риском кардиометаболических заболеваний у более 300 мужчин-участников долгосрочного исследования под наблюдением медицинских работников (Health Professionals Follow-up Study, HPFS).
Обнаружена значимая связь между режимом питания, характеристиками микробиома кишечника и риском кардиометаболических заболеваний. Результаты исследования показали, что длительная приверженность здоровому рациону MedDiet связана с положительными таксономическими и ферментативными изменениями со стороны микробиома кишечника. Особенности питания объясняли 0,7% изменений, что превышало показатель, связанный с применением антибиотиков. Приверженность MedDiet была связана с усилением микробной деградации пищевых волокон и ферментацией короткоцепочечных жирных кислот анаэробными метаболизаторами, такими как F. prausnitzii и E. rectale. Низкая приверженность MedDiet и употребление красного или обработанного мяса были связаны с повышенным синтезом гепатотоксических вторичных желчных кислот, в основном производимыми микроорганизмом C. aerofaciens. Это подчеркивает способность MedDiet снижать риск кардиометаболических заболеваний при отсутствии Prevotella copri. В то время как увеличение индекса MedDiet было связано со снижением риска инфаркта миокарда у пациентов, не являющихся носителями P. copri. Носители P. copri имели повышенный риск.
Следовательно, микробиологический профиль кишечника человека можно использовать для оценки эффективности коррекции диеты и профилактики сердечно-сосудистых заболеваний. Для лиц, не являющихся носителями P. copri, MedDiet может стать основой профилактики сердечно-сосудистых заболеваний, в то время как носители P. copri получат больше пользы от физических упражнений или применения статинов.
Хотя антибиотикопрофилактика (АП) может снизить риск возникновения серьезной инфекции у пациента с ослабленным иммунитетом, основным ее недостатком является индукция резистентности к антибиотикам. Применение фторхинолонов широкого спектра способствует селекции устойчивых микроорганизмов и развитию перекрестной резистентности к другим антибиотикам. В этом исследовании авторы изучали резистом микробиоты желудочно-кишечного тракта у детей с острым лимфобластным лейкозом (ОЛЛ), чтобы определить влияние АП на гены резистентности к антибиотикам (ГРА).
Участвовали 49 детей с ОЛЛ, из которых 31 (63%) ребенок во время индукционной терапии получал левофлоксацин в качестве профилактического средства, а 18 детей не получали такого лечения. Для профилактики инфекции, вызванной Pneumocystis jirovecii, применялся триметоприм-сульфаметоксазол. Было выявлено увеличение относительной численности генов резистентности микробиоты кишечника к триметоприму- сульфаметоксазолу, не модифицированное в результате профилактики левофлоксацином. К о л и ч е с т в о т о ч е ч н ы х м у т а ц и й г е н а топоизомеразы бактерий увеличилось только в группе левофлоксацина. Левофлоксацин действует на бактериальную топоизомеразу, к о т о р а я к а т а л и з и р у е т о б р а з о в а н и е двухцепочечных разрывов ДНК. Рост числа генов резистентности к фторхинолонам был небольшим, как и количество пациентов с мутациями бактериальной топоизомеразы. Н е с м о т р я н а н е б о л ь ш о й к а ж у щ и й с я селективный эффект левофлоксацина, увеличение частоты случаев резистентности к фторхинолонам сохранялось в течение как минимум 2 месяцев после завершения профилактического лечения. Напротив, после индукционной терапии не было обнаружено никаких изменений в генах устойчивости к аминогликозидам, β-лактамам, ванкомицину и л и м н о ж е с т в е н н ы м л е к а р с т в е н н ы м п р е п а р а т а м , ч т о с в и д е т е л ь с т в у е т о б отсутствии межклассовой устойчивости к любым другим антибиотикам.
В заключение, профилактика фторхинолонами о б е с п е ч и в а е т к р а т к о с р о ч н у ю з а щ и т у от инфекций, но не увеличивает риск возникновения перекрестной резистентности к другим антибиотикам.
Иммунотерапия с целью ингибирования белка программируемой гибели клеток-1 (PD- 1) используется для лечения пациентов с меланомой, но только 10–20% из них удается достичь полной ремиссии. Модуляция микробиоты кишечника показала положительные результаты в доклинических моделях и может стать одним из наиболее перспективных методов повышения эффективности этой терапии. Тем не менее, этот подход еще не изучали в клинических исследованиях. Авторы хотели оценить влияние ТФМ на иммунные клетки у пациентов с рефрактерной метастатической меланомой, которым планировалось проведение иммунотерапии с помощью анти-PD-1.
Сначала пациентам проводили ТФМ (с помощью колоноскопии или путем перорального приема капсул с материалом фекалий), а затем они проходили повторную индукционную терапию анти-PD-1. Материал фекалий был получен от двух доноров (доноры 1 и 2), которые получили лечение метастатической меланомы и достигли полной ремиссии. Умеренных или тяжелых нежелательных явлений после ТФМ отмечено не было. Объективный ответ на лечение был отмечен у трех пациентов, которым выполнили ТФМ от одного и того же донора (1). Один пациент достиг полной и два — частичной ремиссии. У всех пациентов микробиота кишечника после ТФМ отличалась от их исходной в зависимости от донора (1 или 2). У пациентов, ответивших на лечение, отмечалось более высокое относительное содержание Enterococcaceae, Enterococcus и Streptocccus australis, а также более низкое содержание Veillonella atypica, однако связи между таксонами микроорганизмов и ответом на лечение выявлено не было. После ТФМ была обнаружена активация генов, связанных с презентацией пептидов антигенпрезентирующими клетками (АПК). У ответивших пациентов была выявлена активация генов, связанных с активностью АПК, врожденным иммунитетом и интерлейкином-12. Результаты анализа ткани опухоли у реципиентов после лечения обнаружили увеличение экспрессии многих групп генов, связанных с иммунной системой.
Все это показывает, что ТФМ в сочетании с анти-PD-1 терапией является безопасным и потенциально эффективным вариантом лечения рефрактерной метастатической меланомы. Модуляция микробиоты кишечника может помочь преодолеть резистентность к иммунотерапии.
А в т о р ы о б з о р а р а с с м о т р е л и д а н н ы е по изменению микробиоты человека на протяжении всей его жизни, связь между м и к р о б и о т о й к и ш е ч н и к а / м о л о ч н о й ж е л е з ы и р а к о м м о л о ч н о й ж е л е з ы (РМЖ), а также влияние метаболомики и ф а р м а к о м и к р о б и о м и к и н а р и с к возникновения РМЖ, прогноз заболевания и выбор лечения. В то время как эстрогены, высокая плотность молочной железы, диета западного типа, ожирение, алкоголь и генетика являются общепризнанными факторами риска РМЖ, дисбиоз микробиоты кишечника также может играть не последнюю роль в развитии заболевания, влияя на его лечение и прогноз через различные б и о л о г и ч е с к и е п р о ц е с с ы . Б а к т е р и и , продуцирующие β-глюкуронидазу (BGUS), меняют процесс кишечно-печеночной циркуляции эстрогенов и могут увеличить риск возникновения гормонозависимого РМЖ. Как и в случае кишечника, микробные характеристики микробиоты молочной железы у пациентов с РМЖ отличаются от таковых у здоровых женщин. Мы не знаем, являются эти отличия причиной или следствием, однако связь между дисбиозом молочной железы и РМЖ, обусловленную влиянием бактерий и/или их компонентов на локальное иммунное микроокружение, исключать нельзя. (sidenote: Термин эстроболом «совокупность генов кишечных бактерий, продукты которых способны метаболизировать эстрогены» (Plottel and Blaser, 2011). ) 1 о б о з н а ч а е т совокупность генов бактерий кишечника, п р о д у к т ы к о т о р ы х м е т а б о л и з и р у ю т эстрогены. BGUS кишечных бактерий деконъюгирует ксенобиотики и эстрогены, что приводит к их обратному поступлению в п о р т а л ь н ы й к р о в о т о к . Э с т р о г е н ы , возвращаемые в организм под действием BGUS, могут увеличить риск возникновения г о р м о н о з а в и с и м о г о Р М Ж . Д р у г и е к и ш е ч н ы е б а к т е р и и м е т а б о л и з и р у ю т фитоэстрогены, обладающие защитным противоопухолевым действием. Некоторые кишечные бактерии продуцируют экволы и энтеролигнаны, которые могут снизить риск возникновения гормонозависимого РМЖ. Около 20–30% населения западных стран являются носителями микроорганизмов ( и з с е м е й с т в а C o r i o b a c t e r i a c e a e ) , преобразующих изофлавон в эквол, который обладает эстрогенной, антиандрогенной и антиоксидантной активностью. Активация рецепторов свободных жирных кислот короткоцепочечными жирными кислотами м о ж е т в ы з ы в а т ь п р о т и в о о п у х о л е в ы е эффекты. Микробиота молочной железы и к и ш е ч н и к а с п о с о б н а м о д у л и р о в а т ь м и к р о о к р у ж е н и е Р М Ж , ч т о м о ж е т способствовать активации эпителиальной пролиферации, секреции факторов роста, возникновению генетических мутаций и а н г и о г е н е з у . К р о м е т о г о , б а к т е р и и кишечника способны инактивировать химиопрепараты, например, доксорубицин и гемцитабин. Микробиота кишечника также может влиять на эффективность лучевой терапии, причем как в положительную, так и в отрицательную сторону. В з а к л ю ч е н и е , у п а ц и е н т о в с Р М Ж микробиота может служить прогностическим и предсказательным фактором ответа на лечение. В будущем модуляция микробиоты может помочь улучшить результаты лечения пациентов с РМЖ..
О Б З О Р КО Н Г Р ЕССА
Д-р Хосе Франсиско Кадена Леон (José Francisco Cadena León)
Заведующий отделением эндоскопии департамента гастроэнтерологии и нутрициологии в Национальном институте педиатрии, Мехико, Мексика

Д о к л а д ч и к и с а м м и т а п о д ч е р к н у л и в а ж н о с т ь р а н н и х и з м е н е н и й в м и к р о б и о т е к и ш е ч н и к а м л а д е н ц е в , с в я з а н н ы х с р а з в и т и е м и м м у н н о й системы и возникновением хронических н е и н ф е к ц и о н н ы х з а б о л е в а н и й , а также необходимость продолжения и с с л е д о в а н и й в о б л а с т и л е ч е б н о г о п и т а н и я и д р у г и х т е р а п е в т и ч е с к и х вмешательств.
Грудное молоко (ГМ) человека является з о л о т ы м с т а н д а р т о м д л я к о р м л е н и я младенцев в течение первых шести месяцев жизни, поддерживая их оптимальный рост и развитие. В идеале, грудное вскармливание следует продолжать до 2 лет, наряду с дополнительным питанием. ГМ содержит ряд биологически активных компонентов, таких как олигосахариды человеческого молока (ОЧМ) и микроорганизмы (104–105 КОЕ), которые приносят пользу в краткосрочной и долгосрочной перспективе.
Некоторые исследования показывают, что микробиота ГМ отличается от микробиоты полости рта, влагалища, кожи и мекония, в п е р в у ю о ч е р е д ь , б л и з о с т ь ю в и д о в микроорганизмов, что позволяет говорить о существовании специфической микробиоты ГМ (Hunt KM et al. PLoS One 2011:6.e21313).
ГМ определяет рост и развитие микробиоты кишечника младенца в первые 6 месяцев жизни. В течение этого периода микробный п р о ф и л ь м л а д е н ц е в , н а х о д я щ и х с я исключительно на грудном вскармливании, отличается от микробного профиля у детей на частичном грудном вскармливании или искусственном питании, способствуя иммунологическому и метаболическому программированию.
Б а к т е р и а л ь н ы й п р о ф и л ь у д е т е й , родившихся путем кесарева сечения, отличается от такового при вагинальных родах. В последнем случае он очень похож на микробиоту влагалища матери. Некоторые исследования показали, что введение антибиотиков матери (тезисы G-O-084) до начала кесарева сечения ассоциируется с отсроченной колонизацией и менее разнообразной микробиотой.
Обнаружение в ГМ дрожжей и грибков (21,4% случаев) ассоциировалось с ранним применением антибиотиков и более низкой бактериальной нагрузкой, факторами окружающей среды, проживанием в городе, плотностью населения, временем года и наличием атопии у матери.
В своем межгрупповом исследовании Zelca et al. (N-ePwP-049) изучали характеристики микробиоты желудочно-кишечного тракта у м л а д е н ц е в ( 0 – 1 2 м е с я ц е в ) и д е т е й дошкольного возраста (до 5 лет), связанные с питанием и факторами окружающей среды. Авторы сообщили о преобладании B i f i d o b a c t e r i um у м л а д е н ц е в , м а т е р и которых не получали антибиотики во время беременности, а также Bacteroides, Blautia и Ruminococcus у детей дошкольного возраста.
В с в о е м и с с л е д о в а н и и н а м о д е л и экосистемы кишечника человека Kawata MS (N-ePwP-042) изучал влияние детской смеси, обогащенной ОЧМ [2’фукозиллактоза (Nnt. 0,5 г/л)], на микробиоту и ее метаболиты. Автор сообщил о преобладании таксонов Actinobacteria и Firmicutes, в основном Bifidobacterium и Lactobacillus, росте уровня короткоцепочечных жирных кислот (бутират, ацетат и пропионат) и снижении содержания Enterobacteriaceae spp..
О Ч М с п е ц и ф и ч е с к и в л и я ю т н а Bifidobacterium spp, способствуя продукции к о р о т к о ц е п о ч е ч н ы х ж и р н ы х к и с л о т , аналогичных тем, что содержатся в ГМ (Walsh C. et al, N-eP-133).
Более глубокое понимание процесса ранней колонизации кишечника в течение первых 6 месяцев жизни и факторов риска, способных нарушить развитие иммунной системы, позволят нам создать новые эффективные методы лечения.
КОНГРЕСС DDW
Д-р Эрика Монтихо Барриос (Ericka Montijo Barrios)
Специалист по детской гастроэнтерология и эндоскопии, факультет гастроэнтерологии и питания, Национальный институт педиатрии, общество NASPGHAN, Мехико, Мексика

Неделя болезней органов пищеварения (DDW) 2021 проходила в онлайн-режиме с 21 по 23 мая 2021 года. Это была первая встреча врачей и исследователей в области гастроэнтерологии, гепатологии, эндоскопии и хирургии.
Докладчики представили более 300 о р и г и н а л ь н ы х л е к ц и й и с т е н д о в ы х докладов [1-7].
Микробиом кишечника можно рассматривать к а к д и н а м и ч е с к и й о р г а н , в к о т о р о м происходит множество биохимических реакций, влияющих на наше здоровье и предрасположенность к заболеваниям. Н а р у ш е н и е э т о г о р а в н о в е с и я м о ж е т нарушить физиологические процессы в о р г а н и з м е и п р и в е с т и к р а з в и т ию заболеваний, среди которых в первую очередь следует выделить функциональные гастро-интестинальные расстройства (ФГИР).
Факторы, модифицирующие микробиоту в з р о с л о г о ч е л о в е к а , в к л ю ч а ю т психологический стресс, инфекционный гастроэнтерит, физическую активность, к у р е н и е , у п о т р е б л е н и е а л к о г о л я , антибиотики и питание (включая диету с низким содержанием ферментируемых о л и г о с а х а р и д о в , д и с а х а р и д о в , моносахаридов и полиолов). Известно, что дисбиоз на фоне применения антибиотиков м о ж е т п р и в е с т и к г и п е р а л г е з и и . П о с т а т и с т и к е в р а ч и г о р а з д о ч а щ е назначают антибиотики пациентам с ФГИР по сравнению с теми, кто не имеет этого заболевания, и что более чем в 25% случаев первые проявления ФГИР наблюдались после антибиотикотерапии [4].
С т и м у л я т о р ы м о т о р и к и ж е л у д о ч н о - к и ш е ч н о г о т р а к т а б а к т е р и а л ь н о г о п р о и с х о ж д е н и я в к л ю ч а ю т 1 ) короткоцепочечные жирные кислоты (КЦЖК), которые увеличивают биосинтез серотонина, повышают чувствительность толстой кишки и снижают висцеральную чувствительность, 2) желчные кислоты, которые стимулируют перистальтику толстой кишки и секрецию, 3) метан, который повышает сократительную способность тонкой кишки и замедляет кишечный транзит, 4) газообразный водород, который ускоряет транзит.
Возникновение боли при некоторых ФГИР можно объяснить повышенной висцеральной ч у в с т в и т е л ь н о с т ь ю к м е х а н и ч е с к и м и химическим стимулам. Большая часть сведений о роли микробиома кишечника в регуляции ощущений со стороны ЖКТ получена из исследований гнотобионтов, к о т о р ы е п о к а з а л и в о з м о ж н о с т ь п е р е н о с а ф е н о т и п а в и с ц е р а л ь н о й гиперчувствительности от пациентов с ФГИР к стерильным мышам с помощью ТФМ.
Ф Г И Р — э т о г р у п п а з а б о л е в а н и й , которые чаще всего являются причиной висцеральной боли. Воспалительная боль возникает в результате повышения нервной возбудимости при изменении активности и о н н ы х к а н а л о в в п е р и ф е р и ч е с к и х ноцицептивных сенсорных волокнах под действием воспалительных медиаторов. В перечень провоспалительных медиаторов входят ФНО-α, ИЛ-1β, CCL2, хемокин, лиганд 1 и простагландин Е2. Показано, что стерильные мыши гораздо легче переносят воспалительную боль, вызванную этими медиаторами, благодаря повышенному уровню противовоспалительного цитокина ИЛ-10.
М и к р о б н ы й д и с б и о з м о ж е т в ы з ы в а т ь л о к а л и з о в а н н ы й и м м у н н ы й о т в е т , связанный с образованием антител класса IgE к антигенам пищи, что в итоге приводит к гипералгезии, опосредованной тучными клетками. Бактериальный гистамин может вызывать гипералгезию через сигнальные пути, опосредованные H4R. Введение пищевых антигенов (глютена, пшеницы, сои и молока) в слизистую оболочку прямой или сигмовидной кишки у пациентов с синдромом р а з д р а ж е н н о г о к и ш е ч н и к а в ы з ы в а л о местный отек и активацию тучных клеток.
Применение антибиотиков часто предшествует первым симптомам функциональных нарушений со стороны желудочно-кишечного т р а к т а . В с е б о л ь ш е д а н н ы х показывает, что дисбиоз тонкой к ишк и и г р а е т в ажн ую р о л ь в патофизиологии ФГИР. В свою очередь, микробиота кишечника может влиять на выраженность боли в животе.
М и к р о б н ы й д и с б и о з м о ж е т вызвать гипералгезию, которая способствует возникновению слабовыраженных воспалительных реакций в стенке кишки.
1 Shin A, Preidis GA, Shulman R, Kashyap, P. The gut microbiome in adult and pediatric functional gastrointestinal disorders. Clin Gastroenterol Hepatol 2019; 17: 256-74.
2 Santoni M, Miccini F, Battelli N. Gut microbiota, immunity and pain. Immunol Lett 2021; 229: 44-7.
3 Gurusamy S, Shah A, Talley N, et al. Small Intestinal Bacterial Overgrowth in functional Dyspepsia: A systematic review and meta-analysis. DDW ePoster Library 2021; 320192; Sa389.
4 Jones M, Walker M, Holtmann G, et al. Antibiotics frequently precede first diagnosis of functional gastrointestinal disorders. DDW ePoster Library 2021; 319221; Fr071.
5 Bercik P. Host-microbe interactions as a means of understanding visceral hypersensivity. Conference. DDW2021 virtual. May 21-23.
6 Kashyap P. Small Intestinal Bacterial Overgrowth Hype: Role of dietary fiber. Conference. DDW2021 virtual. May 21-23.
7 Microbes and functional GI disease: The science behind the hype. Lecture. DDW2021 virtual. May 21-23.
Стоматит, гингивит, кариес, пародонтоз… Даже при антиретровирусном лечении люди с ВИЧ имеют риск болезней полости рта. Не все механизмы ясны, но, вероятно, играют роль персистирующее воспаление и дисбаланс микробиоты полости рта.
Микробиота Лор-Органов
По случаю Всемирного Дня борьбы со СПИДом 1 декабря давайте вспомним, что ВИЧ атакует Т-лимфоциты CD4. Ослабление иммунной системы способствует возникновению оппортунистических инфекций, рака и других заболеваний органов. С помощью антиретровирусной терапии количество Т-лимфоцитов CD4 может быть восстановлено, а вирусная нагрузка снижена до неопределяемого уровня. Но это не означает, что все негативные последствия инфекции исчезают. У людей с ВИЧ часто встречается воспаление полости рта, что связано с дисбалансом микробиоты полости рта.
При ВИЧ-инфекции Т-клетки CD4 истощаются в борьбе с вирусом, который разрушает клетки или мешает им правильно функционировать. Кроме того, нарушается баланс кишечной микробиоты, развивается дисбиоз : одни полезные бактерии (например, (sidenote: Лактобактерии Палочковидные бактерии, основным свойством которых является производство молочной кислоты, в связи с чем их еще называют «молочнокислые бактерии». Лактобактерии присутствуют в микробиоте полости рта, влагалища и кишечника человека, а также в организме животных и в растениях. Они содержатся в ферментированных продуктах — сырах, йогуртах, соленых огурцах, квашеной капусте и т. д. Лактобактерии также содержатся в пробиотиках, причем своими полезными свойствами пробиотики обязаны именно некоторым видам лактобактерий. W. H. Holzapfel et B. J. Wood, The Genera of Lactic Acid Bacteria, 2, Springer-Verlag, 1st ed. 1995 (2012), 411 p. « The genus Lactobacillus par W. P. Hammes, R. F. Vogel Tannock GW. A special fondness for lactobacilli. Appl Environ Microbiol. 2004 Jun;70(6):3189-94. Smith TJ, Rigassio-Radler D, Denmark R, et al. Effect of Lactobacillus rhamnosus LGG® and Bifidobacterium animalis ssp. lactis BB-12® on health-related quality of life in college students affected by upper respiratory infections. Br J Nutr. 2013 Jun;109(11):1999-2007. ) ) уменьшаются в пользу других, в том числе (sidenote: патоген это микроорганизм, который вызывает или может вызвать заболевание; см. Pirofski LA, Casadevall A. Q and A: What is a pathogen? A question that begs the point. BMC Biol. 2012 Jan 31;10:6. ) . Инфекция поражает слизистую кишечника, повышается ее проницаемость и высвобождает свое содержимое, вызывая воспаление, которое распространяется по организму и повреждает органы. Создается порочный круг, так как воспаление способствует размножению вируса! Ранняя антиретровирусная терапия сохраняет целостность слизистой кишечника и баланс кишечной микробиоты, но не предотвращает персистенцию воспаления, что увеличивает риск заболеваний полости рта.
Почему ВИЧ-инфекция, контролируемая лечением, ослабляет слизистую оболочку полости рта и увеличивает риск заболеваний полости рта? Возможно, из-за снижения выработки в слюне секреторного иммуноглобулина А - основной линии защиты от оральных патогенов. Возможно, также потеря Т-клеток CD4 вызывает воспаление и дисбиоз полости рта. Пока мало исследований по микробиоте полости рта ВИЧ-инфицированных, а их результаты не всегда согласуются друг с другом. Также сложно оценить воздействие самого вируса и лечения на микробиоту полости рта.
(sidenote: Научный обзор от сентября 2021 г. содержит новую информацию ) . Уже предложено «пробиотическое» решение для предотвращения заболеваний полости рта, исследователи изучают бактерии, которые вызывают кариес, чтобы сделать их менее патогенными. Также ученым необходимо проверить эффективность пробиотических штаммов на оральные иммунные функции.
Coker, Modupe O et al. “HIV-Associated Interactions Between Oral Microbiota and Mucosal Immune Cells: Knowledge Gaps and Future Directions.” Frontiers in immunology vol. 12 676669. 20 Sep. 2021.
МИКРОБИОТА И COVID-19
Проф. Джерард Райт (Gerard D. Wright)
Институт исследований инфекционных заболеваний им. М.Г. ДеГрута, Университет МакМастер, Гамильтон, Канада

Пандемия COVID-19 серьезно повлияла на здоровье людей. Finlay et al. исследуют, как COVID-19 и меры по борьбе с инфекцией влияют на общее состояние здоровья людей [1]. Наши действия во время пандемии могут значительно повлиять на микробиом инфицированных и неинфицированных людей с возможными последствиями для здоровья в будущем. Все больше данных указывает на уменьшение разнообразия микробиомов человека во всем мире, причем за последние несколько десятилетий этот процесс ускорился наряду с параллельным ростом числа хронических неинфекционных заболеваний. Пандемия COVID-19 может усугубить эти проблемы за счет уменьшения разнообразия нашей микробиоты, обусловленного усилением гигиенических процедур, изменением доступа к продуктам питания, снижением социальных контактов и т. д.На данном этапе долгосрочное влияние пандемии на микробиом и, как следствие, на здоровье человека еще не так очевидно. Текущая ситуация с COVID-19 предоставляет уникальную «живую лабораторию» для изучения в режиме реального времени того, как пандемии могут влиять на здоровье человека в краткосрочной и долгосрочной перспективе, а также того, как эти последствия могут повлиять на людей и сообщества.
Разнообразие микробиома человека в разных странах мира неодинаково. На него влияют питание, география, уровень дохода, общественные устройства и многие другие факторы [2]. Общая тенденция к утрате разнообразия микробиомов, особенно в развитых странах, коррелирует с изменениями в рационе питания (увеличение потребления обработанных продуктов питания), доступом к чистой воде, использованием антибиотиков (и злоупотреблением ими) и общим улучшением гигиены. Оригинальная «гипотеза гигиены» и ее более поздние модификации предполагают, что такое снижение микробного разнообразия напрямую связано с недостаточным «обучением» иммунной системы, особенно в раннем возрасте. Это повышает восприимчивость к целому ряду хронических состояний, таких как ожирение, бронхиальная астма и сердечно-сосудистые заболевания [3]. Это также повышает восприимчивость к инфекциям. Точно так же старение часто связано с уменьшением генетического разнообразия микробиоты человека и повышенной восприимчивостью к инфекциям [4]. По опыту прошлого года мы знаем, что люди с хроническими заболеваниями и пожилые люди, которые обычно имеют менее разнообразный микробиом, гораздо чаще заболевают SARS-CoV-2 с неблагоприятными исходами. Совпадение? Едва ли. Кроме того, инфекция SARS-CoV-2 часто ассоциируется с нарушениями со стороны желудочно-кишечного тракта [5], степень которых коррелирует с наличием рецепторов АПФ-2 [6] и с дисбиозом кишечника.
Повсеместное использование антисептиков, тщательная дезинфекция зданий, общественных мест и объектов не может не сказаться на микробном разнообразии. Также прогнозируются изменения в доступе к продуктам питания и их потреблении в связи с переходом к приготовлению пищи дома, рост употребления алкоголя и потенциальные проблемы с продовольственной безопасностью в некоторых частях мира в связи с сокращением поездок и доступа к товарам. Изменение социальных отношений может также оказывать глубокое влияние на разнообразие микробиома. Локдауны, удаленная работа, закрытие учреждений долгосрочного ухода потенциально могут привести к изменениям, которые будут способствовать росту числа воспалительных и инфекционных заболеваний. Различия санитарно-эпидемической обстановки между регионами мира также способны оказать заметное влияние на микробиом человека. Санитарно-гигиенические факторы влияют на заболеваемость COVID-19, например, показатели качества воды обратно коррелируют со смертностью от COVID-19 [7]. Все эти области требуют серьезного изучения и внимания.
Finlay et al. утверждают, что влияние пандемии COVID-19 на разнообразие микробиома и здоровье человека нужно исследовать в режиме реального времени и в долгосрочной перспективе на протяжении всей жизни (рисунок 1). Это даст возможность более полно оценить последствия пандемии и выработать более эффективные подходы на будущее. Кроме того, результаты этих длительных наблюдений помогут нам больше узнать о влиянии микробиоты на здоровье человека вне связи с острыми инфекциями. Уже появляются сообщения о связанных с пандемией изменениях в микробиоме человека, в том числе о том, как особенности п е р е м е щ е н и я л ю д е й в л и я ю т н а е г о разнообразие [8]. Показано, что даже через 6 месяцев после заболевания у пациентов, инфицированных SARS-CoV-2, не происходит полного восстановления разнообразия микробиома [9]. Изменения правил ухода за новорожденными, по крайней мере на ранних стадиях пандемии, такие как ограниченный контакт кожи с кожей и сокращение грудного вскармливания, потенциально могут изменить их микробиоту, что вызовет долгосрочные последствия для здоровья. С другой стороны, более частые контакты с домашними животными и детьми в случаях, когда родители работают из дома, могут оказать балансирующий эффект. Наконец, неизвестно, как уменьшение социальных контактов повлияет на здоровье детей младшего возраста и подростков, лишенных возможности посещать школу или участвовать в спортивных и общественных мероприятиях. Потребуется много лет, чтобы понять, как продолжительный стресс, вызванный изоляцией, снижение социальной активности и прочие факторы влияют на микробные экосистемы организма человека в долгосрочной перспективе.
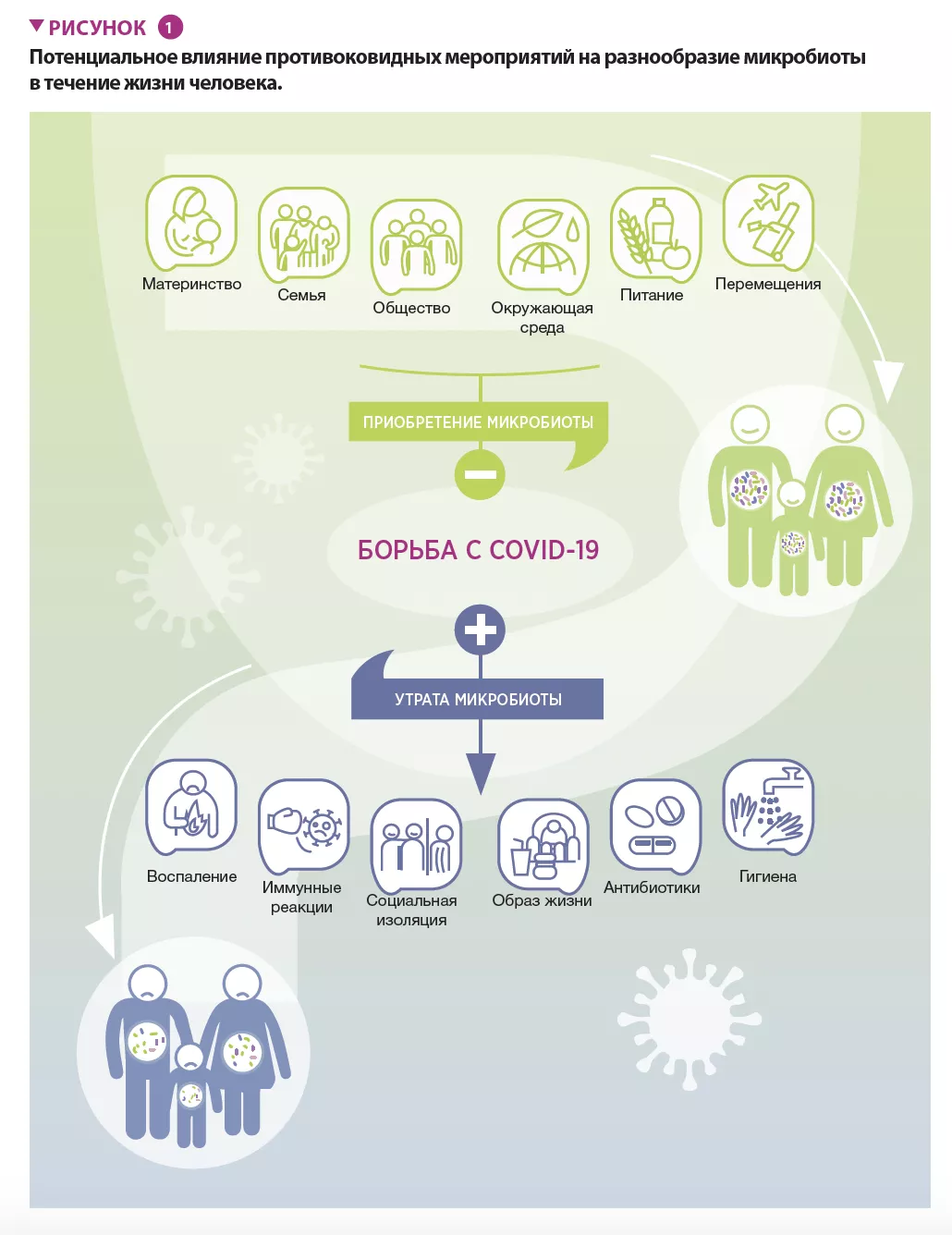
Разнообразие микробиома имеет важное значение для здоровья человека. Прослеживается взаимосвязь между уменьшением микробного разнообразия и повышенным риском развития хронических и инфекционных заболеваний. COVID-19 прямо и косвенно влияет на микробиом человека, что, в свою очередь, может повлиять на нашу восприимчивость к инфекциям и здоровье в долгосрочной перспективе. Хотя текущая пандемия носит глобальный характер, ее последствия в разных странах и регионах неодинаковы. Пока неизвестно, как различия в возрасте, состоянии здоровья, питании, доступе к средствам гигиены и общественных нормах влияют на баланс нашей микробиоты в краткосрочной и долгосрочной перспективе, все эти вопросы требуют изучения.
1 Finlay BB, Amato KR, Azad M, et al. The hygiene hypothesis, the COVID pandemic, and consequences for the human microbiome. Proc Natl Acad Sci USA 2021; 118: e2010217118.
2 Porras AM, Brito IL. The internationalization of human microbiome research. Curr Opin Microbiol 2019; 50: 50-5.
3 Stiemsma LT, Reynolds LA, Turvey SE, et al. The hygiene hypothesis: current perspectives and future therapies. Immunotargets Ther 2015; 4: 143-57.
4 DeJong EN, Surette MG, Bowdish DME. The gut microbiota and unhealthy aging: disentangling cause from consequence. Cell Host Microbe 2020; 28: 180-9.
5 Cha MH, Regueiro M, Sandhu DS. Gastrointestinal and hepatic manifestations of COVID-19: A comprehensive review. World J Gastroenterol 2020; 26: 2323-32.
6 Vuille-Dit-Bille RN, Lischty KW, Verrey F, et al. SARS-CoV-2 receptor ACE2 gene expression in small intestine correlates with age. Amino Acids 2020; 52: 1063-5.
7 Kumar P, Chander B. COVID 19 mortality: Probable role of microbiome to explain disparity. Med Hypotheses 2020; 144: 110209.
8 Peng Y, Zhang D, Chen T, et al. Gut microbiome and resistome changes during the first wave of the COVID-19 pandemic in comparison with pre-pandemic travel-related changes. J Travel Med 2021 [Epub ahead of print].
9 Chen Y, Gu S, Chen Y, et al. Six-month follow-up of gut microbiota richness in patients with COVID-19. Gut 2021 [Epub ahead of print].
Язык как мода. То, что было популярно 20 лет назад, сейчас не популярно, но может вернуться в будущем. Например, термин флора, подразумевающий кишечную флору, уступил место микробиоте, которая существует не только в кишечнике, но и в носу, во рту, во влагалище, на коже и т. д. Однако, микробиоту не следует путать с микробиомом.

Как только мы обращаемся к нашему микромиру, появляются определенные термины, которые не всегда имеют четкое определение или используются надлежащим образом. Поэтому необходимы некоторые определения.
Термин «флора» существует дольше всех. Когда-то он относилось к пищеварительной системе («кишечная флора») и обозначал, согласно медицинскому словарю Ларусса, «скопление микроорганизмов, которые обычно обитают в кишечнике». В то время считали, что кишечная флора состоит в основном из бактерий1. Поэтому, когда использовался термин «флора», он относился к бактериальной популяции кишечника.
&С развитием науки такой взгляд на флору оказался упрощенным. С одной стороны, пищеварительная система содержит не только бактерии содержит не только бактерии, но и вирусы, грибы (включая дрожжи) и паразиты2.
As science progressed, this view of the flora proved to be far too simplistic. On the one hand, our digestive system hosts far more than bacteria. Viruses, fungi (including yeasts), and parasites also make it their home2.
все имеют свою флору.…3
Постепенно появился термин — «микробиота». Этот термин однозначно относится ко всем микроорганизмам в их составе (а не только к бактериям). Микробиота разных локализаций, например кожи, полости рта и т. д. имеет свой характерный набор микроорганизмов.
Иногда разница висит на нитке, а точнее на паре букв. Действительно, всего две буквы отделяют «микробиоту» от «микробиома». И все же эти два термина — ложные друзья. Микробиота- популяция бактерий, вирусов и т. д., обитающих в определенной области тела, а Микробиом — генетический материал этого сообщества. Представьте себе, что все микроорганизмы, составляющие микробиоту, помещают в блендер, тем самым стирая их индивидуальную идентичность, и оставляя только генетический материал полученного микробного супа. В деревне «микробиотой» будет список жителей, а «микробиомом» — список того, что эти жители коллективно умеют делать (печь хлеб, строить дом и т. д).
Термины «микробиота» и «микробиом» часто используются без различия, и в некоторых статьях, переведенных с английского на другие языки, эти два термина смешиваются. По крайней мере, теперь вы знаете, как отличить.
КОММЕНТАРИИ К СТАТЬЕ РАЗДЕЛ, ПОСВЯЩЕННЫЙ ДЕТЯМ
Проф. Эммануэль Мас (Emmanuel Mas)
Отделение гастроэнтерологии и нутрициологии, Детская больница, Тулуза, Франция

Некоторые нарушения развития у детей могут быть связаны с ожирением матери. Однако механизмы этого явления и возможные подходы к лечению пока неизвестны. Результаты межгруппового исследования с участием 778 китайских детей в возрасте от 7 до 14 лет показывают, что наличие ожирения у матери сильно коррелирует с низкой когнитивной функцией и социализацией у детей. Данные, полученные у мышей, показывают, что материнское ожирение нарушает как поведение, так и микробиоту кишечника детенышей. Диета с высоким содержанием клетчатки, которую получали матери или потомство, уменьшала выраженность нарушений за счет улучшения синаптической проводимости и созревания микроглии. Результаты экспериментов по трансплантации фекальной микробиоты (ТФМ) позволили выявить причинно-следственную связь между нарушением микробиоты и изменением поведения. Кроме того, потребление короткоцепочечных жирных кислот, полученных из микробиоты, улучшало поведение потомства мышей, родившихся от самок с ожирением. Вывод: ось микробиота/метаболиты микробиоты — головной мозг может способствовать развитию когнитивной и социальной дисфункции у детей, родившихся от матерей с ожирением, а высокое потребление пищевых волокон может помочь в решении этой проблемы.
Ожирение все чаще встречается у женщин детородного возраста, что приводит к более высокому риску развития сахарного диабета, гипертонии и поведенческих нарушений у детей. По данным широкомасштабных исследований, у таких детей повышен риск возникновения когнитивных нарушений и расстройств аутистического спектра. Эти нарушения были воспроизведены у мышей, беременные самки которых получали диету с высоким содержанием жиров (ДВЖ). Такая пища и ожирение сильно влияют на микробиоту кишечника. Есть данные о существовании связи между микробиотой кишечника и функционированием головного мозга. Диета с высоким содержанием клетчатки способствует усилению выработки короткоцепочечных жирных кислот (КЦЖК), которые могут быть теми метаболитами, которые связывают оба органа в одну ось.
В исследовании участвовали 778 детей в возрасте 7–14 лет. У 79 из них матери страдали ожирением или избыточным весом. Дети этих матерей имели отклонения в когнитивной или социальной сфере (р < 0,05), более выраженные у мальчиков по сравнению с девочками.
Детеныши мышей, родившиеся от самок, получавших ДВЖ в течение 12 недель, имели нарушения памяти и социальных взаимодействий по сравнению с теми, которые родились от самок, получавших контрольную диету (КД) (p < 0,01). Результаты кормления самок четырьмя видами пищи (КД, ДВЖ, ДВЖК [диета с высоким содержанием жиров и клетчатки] и ДВК [диета с высоким содержанием клетчатки]) в течение 12 недель показали, что ДВЖК и ДВК снижали выраженность нарушений памяти и социального взаимодействия у потомства (p < 0,01). Это ассоциировалось с повышением плотности постсинаптических контактов в гиппокампе у потомства самок, получавших ДВЖК, по сравнению с потомством самок, получавших ДВК (p < 0,05), и различиями в экспрессии генов в микроглии гиппокампа и префронтальной коры.
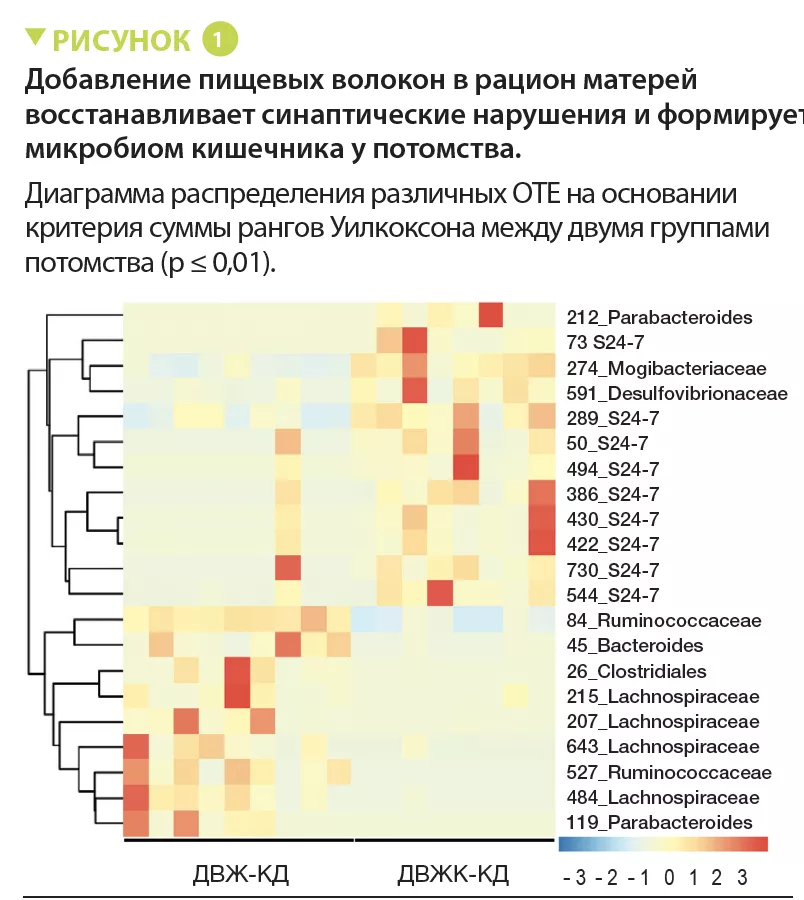
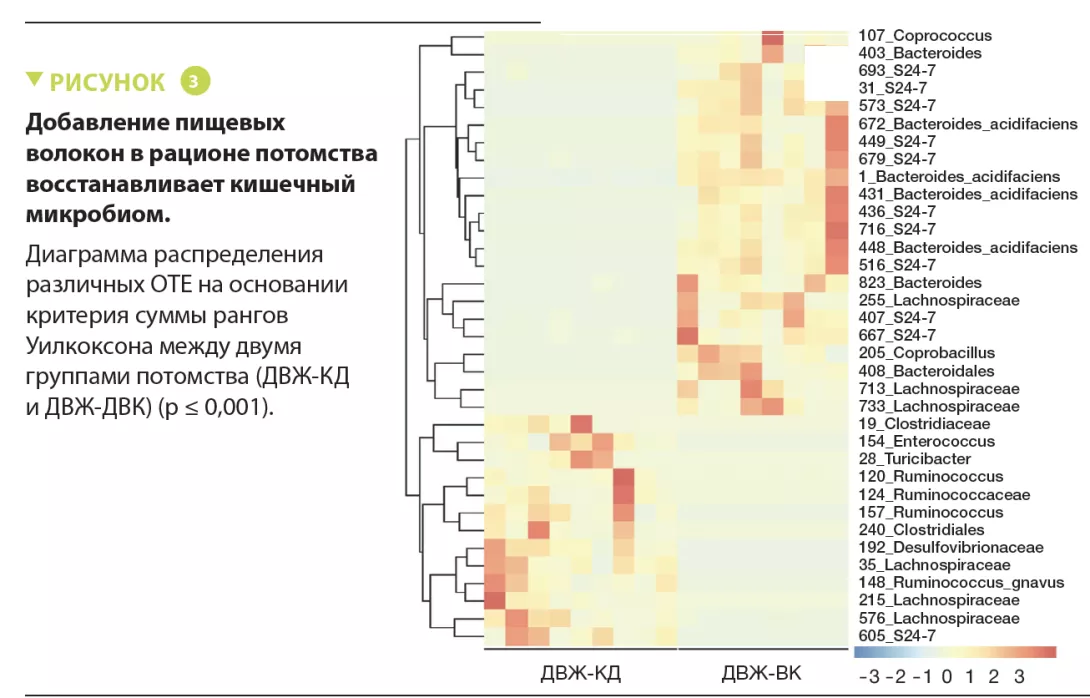
Этот эффект диеты с высоким содержанием клетчатки связан с модификацией состава микробиоты кишечника, что было показано с помощью секвенирования 16S. Результаты анализа ОТЕ (операционных таксономических единиц) показали увеличение содержания 21 бактериального таксона в группе ДВЖК по сравнению с ДВЖ, 9 из которых принадлежали к семейству S24-7(рисунок 1). Преобладание 5 ОТЕ положительно к о р р е л и р о в а л о с к о г н и т и в н ы м и и социальными поведенческими нарушениями (p < 0,05). Диета с высоким содержанием к л е т ч а т к и в о с с т а н а в л и в а л а у р о в н и пропионата и ацетата в фекалиях потомства, но не влияла на содержание бутирата (p < 0,01).
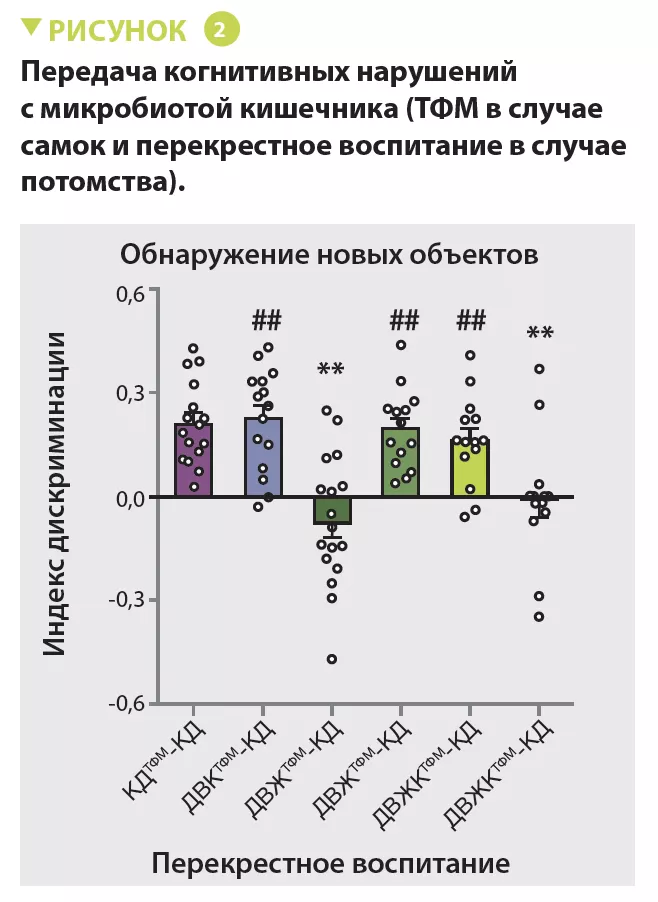
Результаты эксперимента с трансплантацией фекальной микробиоты (ТФМ) показали, что эффект диеты с высоким содержанием клетчатки передавался через микробиоту материнского кишечника. Во-первых, ТФМ от самок из группы ДВЖ изменяла когнитивные и социальные характеристики потомства, что корректировалось диетой с высоким содержанием клетчатки. Во- вторых, перекрестное воспитание потомства самками из групп ДВЖТФМ и ДВЖКТФМ индуцировало поведенческие изменения у потомства самок из группы ДВЖКТФМ, выращенного самками из группы ДВЖТФМ, и улучшение поведения у потомства самок из группы ДВЖТФМ, выращенного матерями из группы ДВЖКТФМ (рисунок 2). Последние эффекты можно объяснить переносом микробиоты от самок к детенышам путем копрофагии.
Добавление клетчатки в рацион потомства самок из группы ДВЖ корректировало поведенческие и социальные нарушения. У д е т е н ы ш е й с а м о к и з г р у п п ы Д В Ж , получавших рацион с высоким содержанием клетчатки (ДВЖ-ВК), также отмечалось преобладание S24-7. В фекалиях детенышей матерей из группы ДВЖ, получавших с т а н д а р т н ы й р а ц и о н , б ы л о б о л ь ш е Bacteroides и меньше — Ruminococcus, тогда как для детенышей матерей из группы ДВК, получавших рацион с высоким содержанием клетчатки, было верно обратное (рисунок 3). Это также ассоциировалось с различиями в когнитивном и социальном поведении. Как и в случае матерей, добавление волокон в корм потомства приводило к повышению уровня КЦЖК. Добавление ацетата и пропионата в питьевую воду улучшало когнитивные и социальные способности, а т а к ж е м о р ф о л о г и ю г и п п о к а м п а и префронтальной коры.
Коррекция рациона питания матерей с ожирением или их детей с помощью добавок пищевых волокон или коррекция дисбиоза микробиоты открывает новые перспективы для улучшения когнитивных и социальных возможностей у детей.
Когнитивный и социальный дефицит у детей, рожденных от матерей с ожирением, обусловлен изменениями микробиоты кишечника, передаваемой от матери ребенку. Эти нарушения у матери или ребенка корректируются с помощью пищевых добавок с клетчаткой. Данный эффект опосредуется короткоцепочечными жирными кислотами, ацетатом и пропионатом.
КОММЕНТАРИИ К СТАТЬЕ РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, Больница Сен-Антуан, Париж, Франция
Иммунотерапия с помощью препаратов, блокирующих белок программируемой гибели клеток-1 (PD-1), приносит долгосрочную клиническую пользу пациентам с распространенной меланомой, даже несмотря на возникающую в ряде случаев устойчивость к терапии. Состав кишечной микробиоты коррелирует с эффективностью этой терапии в доклинических моделях и у онкологических пациентов. Для определения того, можно ли преодолеть резистентность к анти-PD-1 путем модификации кишечной микробиоты, в этом клиническом исследовании оценивали безопасность и эффективность трансплантации фекальной микробиоты (ТФМ) от пациентов с меланомой и ответом на анти-PD-1 пациентам с рефрактерностью к анти-PD-1. Процедура хорошо переносилась, при этом у 6 из 15 пациентов отмечена клиническая польза наряду с быстрым и стойким изменением микробиоты. У пациентов с ответом на лечение отмечалось повышенное содержание таксонов, ранее ассоциированных с ответом на анти-PD-1, таких как Faecalibacterium prausnitzii и Akkermansia muciniphila, повышенная активация CD8+ Т-клеток и снижение доли миелоидных клеток, экспрессирующих интерлейкин-8. Также у них наблюдались различные протеомические и метаболические изменения, контролируемые микробиомом кишечника. В совокупности эти результаты показывают, что ТФМ в сочетании с анти-PD-1 терапией изменяет микробиом кишечника и перепрограммирует микроокружение опухоли на преодоление устойчивости к анти-PD-1 у некоторых пациентов с меланомой.
Блокада иммунных контрольных точек моноклональными антителами, нацеленными на белок программируемой гибели клеток-1 (PD-1), приносит долгосрочную клиническую пользу почти 40% пациентов с распространенной меланомой [2]. В дополнение к внутренним опухолевым механизмам резистентности к анти-PD-1, микробиом кишечника является основным внешним регулятором ответа со стороны опухоли на анти-PD-1 терапию [3]. У мышей микробиом кишечника способен модулировать терапевтическую активность анти-PD-1 и антител, направленных против лиганда PD-1 (PD-1L). Кроме того, введение некоторых комменсальных кишечных бактерий или трансплантация фекальной микробиоты (ТФМ) повышает эффективность анти-PD-1 препаратов у мышей с меланомой [4]. Хотя положительные эффекты микробиома кишечника в отношении ответа на анти-PD-1 у онкологических пациентов отмечали в нескольких исследованиях, точные его характеристики, связанные с наблюдаемыми эффектами, еще не полностью изучены. По данным исследований, с благоприятным ответом на анти-PD-1 терапию при меланоме ассоциируются такие бактерии, как Actinobacteria (Bifidobacteriaceae spp. и Coriobacteriaceae spp.) и Firmicutes (F. prausnitzii). Вопрос, позволяет ли трансплантация микробиоты преодолеть резистентность к анти-PD-1 у пациентов с распространенной меланомой, не изучался. Чтобы ответить на него, авторы разработали открытое несравнительное клиническое исследование для оценки безопасности и эффективности ТФМ от пациентов с меланомой и долгосрочным ответом на анти-PD-1 терапию (R) пациентам с метастатической меланомой, рефрактерной к анти-PD-1.
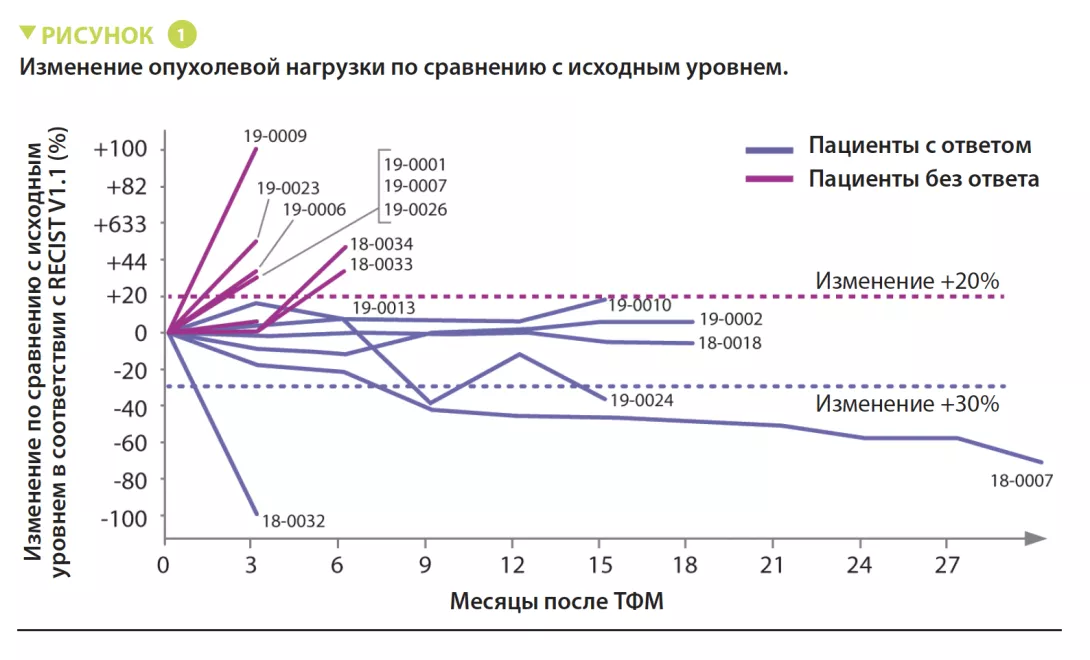
В период с июня 2018 года по январь 2020 года в исследование были включены 16 пациентов с первичной меланомой, рефрактерной к лечению анти-PD-1. Для лечения 16 пациентов использовали материал 7 доноров, 4 из которых имели полный ответ (ПО) и 3 — частичный ответ (ЧО), с медианой выживаемости без прогрессирования (ВБП) 56 месяцев (диапазон: от 45 до 70 месяцев). Каждый пациент получил один трансплантат фекальной микробиоты от одного донора одновременно с получением пембролизумаба. Далее пациенты продолжали получать пембролизумаб каждые 3 недели пока заболевание прогрессировало или неприемлемой токсичности. Рентгенографические оценки проводились каждые 12 недель, а ответ оценивали в соответствии с критериями RECIST v1.1 (рисунок 1). Микробиоту кишечника доноров и реципиентов, собранную до ТФМ, а затем каждую неделю в течение 12 недель и далее каждые 3 недели, анализировали с помощью секвенирования методом дробовика. Пациенты находились под наблюдением в среднем 12 месяцев. Заболевание 1 пациента не поддавалось оценке, поэтому в анализ вошли данные 15 пациентов.
Серьезных побочных эффектов ТФМ отмечено не было. Объективные ответы наблюдались у 3 пациентов, а стабилизация продолжительностью > 12 месяцев наблюдалась еще у 3 пациентов.
Кишечная микробиота у реципиентов претерпела изменения после ТФМ. Состав микробиоты у пациентов, ответивших на лечение, был схож с составом микробиоты доноров, чего нельзя было сказать о пациентах, не ответивших на лечение. У ответивших пациентов отмечалось увеличение содержания представителей филумов Firmicutes (Lachnospiraceae и Ruminococcaceae) и Actinobacteria (Bifidobacteriaceae и Coriobacteriaceae), тогда как у пациентов без ответа наблюдалось уменьшение содержания представителей тип Bacteroidetes.
Хотя успешная колонизация после ТФМ не всегда восстанавливала чувствительность меланомы к анти-PD-1 терапии, в целом наступившие клинические ответы были связаны с ТФМ. Ряд видов бактерий, ассоциированных с клиническим ответом (B. longum, Colinsella aerofaciens и F. prausnitzii), уже был описан ранее.
Результаты иммунологического анализа показали, что ответ на ТФМ был связан с активацией CD8+ Т-клеток. У пациентов с ответом после ТФМ отмечалось снижение уровней нескольких циркулирующих цитокинов, включая MCP1, ИЛ-8 и ИЛ-18 (связанных с резистентностью к PD-1), ИЛ-12p70 и ИФН-γ (связанных с противоопухолевым ответом со стороны Т-клеток).
По данным сетевого анализа повышение содержания комменсалов F. prausnitzii и A. muciniphila у этих пациентов коррелировало с благоприятными лабораторными изменениями, такими как снижение уровня ИЛ-8.
Результаты исследования показывают, что ТФМ может помочь преодолеть резистентность к анти-PD-1 терапии у части пациентов с рефрактерной меланомой. Хотя это предварительные результаты, они подтверждают выводы предыдущего исследования [5] и выступают в пользу проведения новых контролируемых и более масштабных исследований.
Результаты открытого несравнительного исследования показали, что ТФМ может помочь преодолеть резистентность к PD-1 терапии у некоторых пациентов с рефрактерной меланомой. Если эти результаты будут подтверждены в масштабных контролируемых исследованиях, подход в виде модуляции микробиоты на фоне иммунотерапии может совершить революцию в терапии онкологических заболеваний.
1 Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021; 371 : 595-602.
2 Larkin J, Lao CD, Urb a WJ, et al. Efficacy and Safety of Nivolumab in Patients With BRAF V600 Mutant and BRAF Wild-Type Advanced Melanoma. A Pooled Analysis of 4 Clinical Trials. JAMA Oncol 2015 ; 1 : 433-40.
3 Finlay BB, Goldszmid R, Honda K, et al. Can we harness the microbiota to enhance the efficacy of cancer immunotherapy? Nat Rev Immunol 2020 ; 20 : 522-8.
4 Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients. Science 2018 ; 359 : 97-103.
5 Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy- refractory melanoma patients. Science 2021 ; 371 : 602-9.
ОБЗОР
Проф. Премысл Берцик (Premysl Bercik)
Факультет медицинских наук, Университет МакМастер, Научно-исследовательский институт здоровья и пищеварительной системы семьи Фарнкомб, Факультет медицинских наук, Гамильтон, Канада
СРК или синдром раздраженного кишечника характеризуется болью в животе и изменением привычного ритма опорожнения кишечника. Он является наиболее распространенным функциональным расстройством желудочно-кишечного тракта и часто сопровождается психическими нарушениями. Патофизиология заболевания полностью не изучена, но считается, что СРК возникает в результате нарушения коммуникации между кишечником и головным мозгом, причем важную роль в этом процессе играет микробиота. Состав микробиоты и ее метаболическая активность различаются у пациентов с СРК и здоровых людей, однако каких-то специфических профилей микробиоты выявлено не было. Трансплантация фекальной микробиоты от пациентов с СРК мышам, в организме которых не содержатся микроорганизмы, вызывает дисфункцию кишечника, активацию иммунной системы и изменение поведения мышей, аналогичные таковым у пациентов, что предполагает существование причинно-следственной связи. Кроме того, лечение антибиотиками или пробиотиками улучшает симптомы у некоторых пациентов с СРК. Чтобы предложить пациентам с СРК более эффективное лечение нужно изучить взаимодействия между микрофлорой и организмом, которые приводят к симптомам со стороны кишечника и психическим нарушениям. Немаловажен поиск новых биомаркеров, позволяющих отбирать пациентов, которые могут извлечь наибольшую пользу от лечения, направленного на микробиоту.
62% опрошенных считают, что потребление пробиотиков помогает поддерживать здоровый баланс и функцию микробиоты
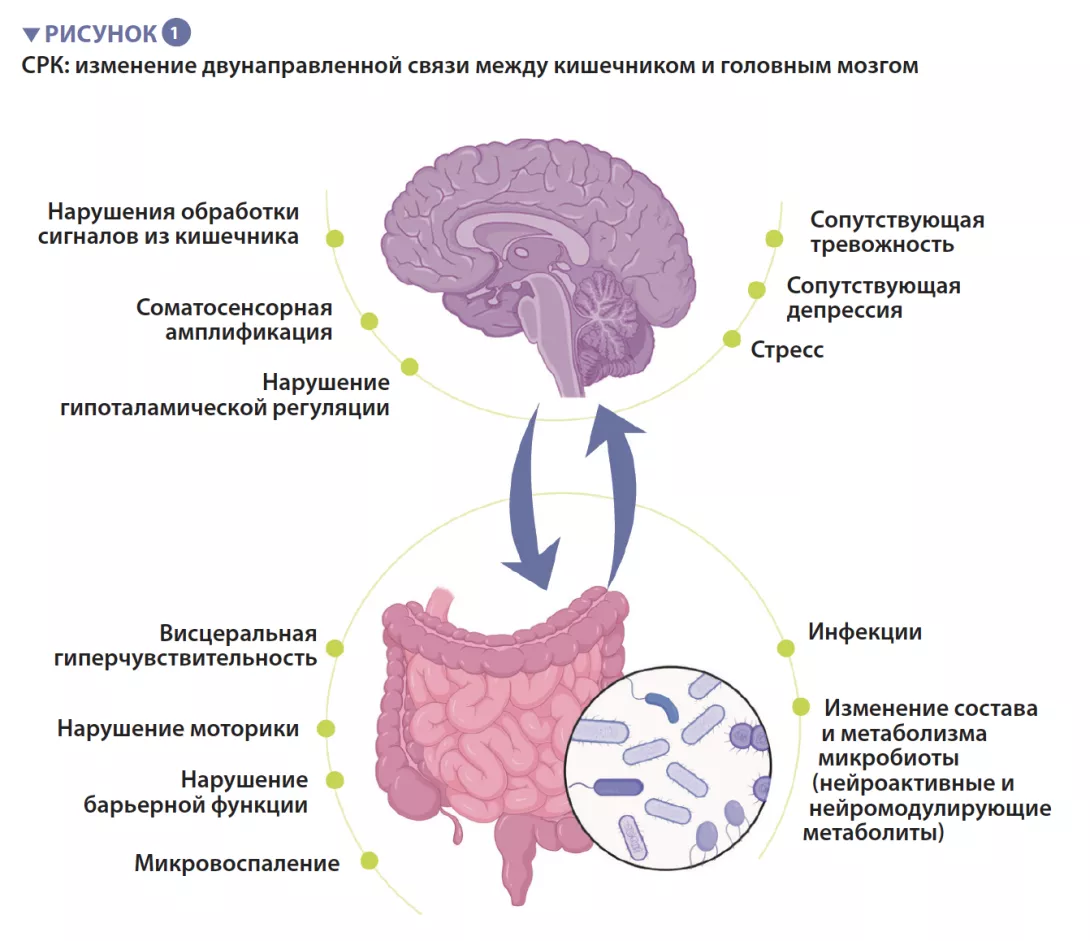
Синдром раздраженного кишечника — это функциональное желудочно-кишечное расстройство, характеризующееся рецидивирующей болью в животе, которая связана с изменениями частоты дефекации или формы кала при отсутствии какого-либо органического расстройства. Согласно римским критериям (ROME IV), выделяют 4 подтипа СРК: СРК с преобладанием запора (СРК-З), СРК с преобладанием диареи (СРК-Д), смешанный вариант (СРК-С) и неклассифицированный вариант (СРК-Н), который не соответствует критериям СРК-З, Д или С [1]. У пациентов с СРК часто встречаются сопутствующие психические нарушения, такие как тревожность, депрессия и соматические расстройства (рисунок 1).
Хотя распространенность СРК различается в разных странах, по оценкам, от этого заболевания страдает приблизительно каждый десятый человек во всем мире [2]. СРК может развиться в любом возрасте, но его начало обычно приходится на период от 20 до 30 лет. У женщин СРК возникает почти в два раза чаще, чем у мужчин. Также у женщин отмечается более выраженная утомляемость и сопутствующие психические нарушения. Качество жизни пациентов с СРК серьезно ухудшается, что нарушает повседневную жизнь, снижая возможность работать или учиться. Экономическое бремя СРК для систем здравоохранения и общества довольно велико и включает как прямые, так и косвенные издержки. Среднегодовые прямые затраты на пациентов с СРК составляют около 1363 евро, плюс пропуск от 8 до 22 рабочих дней в год.
Патофизиология СРК полностью не изучена, но в целом болезнь возникает из-за нарушения функционирования осикишечник — головноймозг, т.е.д в у н а п р а в л е н н о й с в я з и м е ж д у пищеварительным трактом и центральной нервной системой. Предположительно она включает в себя несколько основных механизмов, в том числе периферические ф а к т о р ы , т а к и е к а к в и с ц е р а л ь н а я г и п е р ч у в с т в и т е л ь н о с т ь , и з м е н е н и я моторики, повышение проницаемости кишечника и микровоспаление. Центральные факторы включают нарушения обработки сигналов, поступающих из кишечника, соматосенсорную амплификацию, стресс, а т а кже с о п у т с т в ующи е п с и х и ч е с к и е н а р у ш е н и я , т а к и е к а к т р е в о ж н о с т ь и д е п р е с с и я . В т е ч е н и е п о с л е д н е г о десятилетия все больше внимания уделяется микробиоте кишечника как ведущей причине развития СРК.
В к л и н и ч е с к и х и с с л е д о в а н и я х и экспериментах на животных показана связь между кишечной микробиотой и СРК. Во- первых, бактериальный гастроэнтерит является самым сильным фактором риска СРК, при этом у 11–14% пациентов после острой инфекции, вызванной Campylobacter, S a l m o n e l l a , S h i g e l l a , E s c h e r i c h i a c o l i или Clostridioides difficile, развиваются хронические симптомы [3]. Клинические наблюдения показывают, что женский пол, более молодой возраст, степень тяжести инфекции и существующие психические нарушения являются факторами риска СРК. Также выявлены варианты генов, связанных с проницаемостью кишечника, распознаванием бактерий и врожденным иммунным ответом.
Результаты клинических исследований показали, что некоторые антибиотики могут улучшить симптомы у части пациентов с СРК [4]. С другой стороны, клинические данные также показывают, что применение антибиотиков может вызывать дисбиоз кишечника с последующим появлением с и м п т о м о в С Р К . Н а к о н е ц , д а н н ы е многочисленных клинических исследований п о к а з а л и с п о с о б н о с т ь н е к о т о р ы х пробиотиков улучшать симптомы СРК, такие как боль в животе, диарея или вздутие живота.
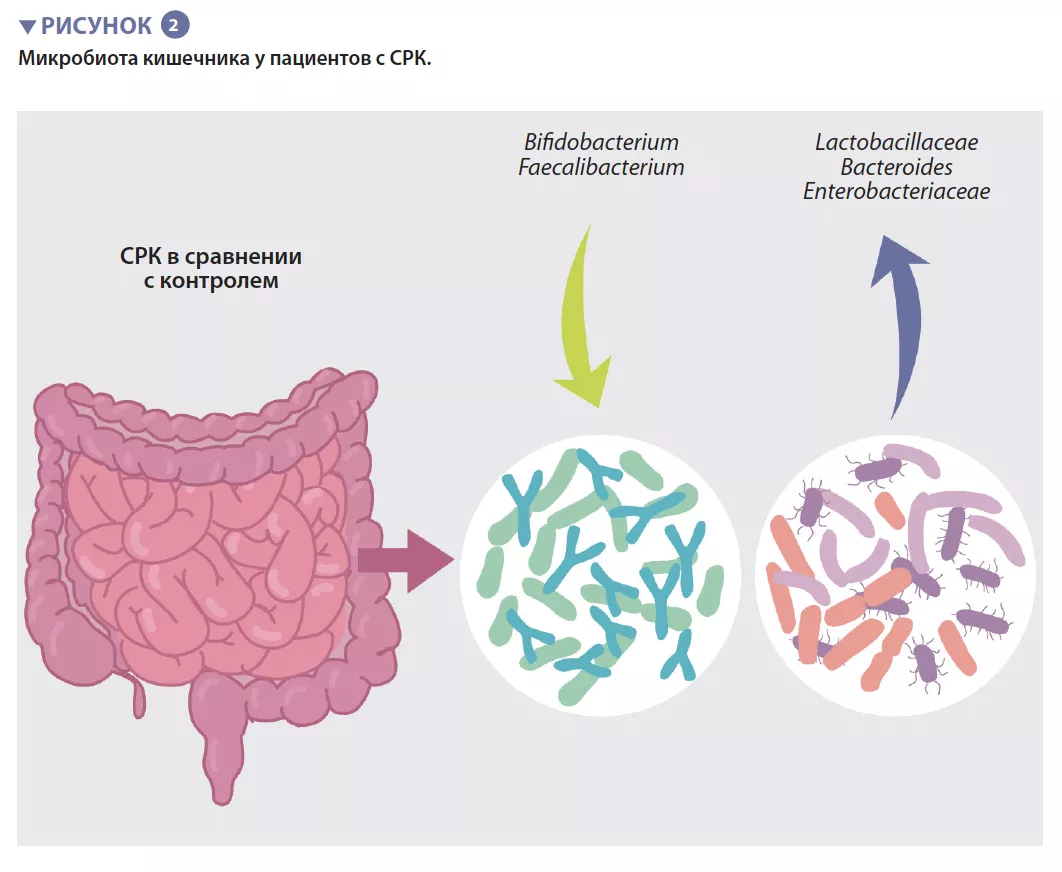
Бактериальная популяция, обитающая в кишечнике, в совокупности называемая кишечной микробиотой, является одним из основных определяющих факторов п о д д е р ж а н и я к и ш е ч н о г о г о м е о с т а з а . Накопленные данные показывают, что м и к р о б н ы й с о с т а в к и ш е ч н и к а и е г о метаболическая активность связаны с кишечными симптомами, тревожностью, д е п р е с с и е й и р а з л и ч а ю т с я м е ж д у пациентами с СРК и здоровыми людьми. О д н а к о и с с л е д о в а н и я п о к а з ы в а ю т , что уникального микробного профиля, который можно было бы отнести к СРК, не существует. Авторы недавнего мета- анализа выявили несколько особенностей м и к р о б и о т ы , в к л ю ч а я у в е л и ч е н и е содержания представителей семейств Enterobacteriaceae, Lactobacillaceae и рода Bacteroides наряду со снижением содержания некультивируемых видов Clostridiales, родов Faecalibacterium и Bifidobacterium у пациентов с С Р К п о с р а в н е н и ю с о з д о р о в ы м и людьми (рисунок 2) [5]. Также обнаружено множество бактериальных метаболитов или метаболитов микробов хозяина, содержание которых изменяется у пациентов с С Р К , в к л ю ч а я ф о с ф а т и д и л х о л и н , дофамин, р-гидроксибензойную кислоту, желчные кислоты, триптамин и метаболиты гистамина. Однако все это ничего не говорит о существовании реальной причинно- следственной связи.
Мышиная модель человеческой микробиоты я в л я е т с я ц е н н ы м и н с т р у м е н т о м д л я установления причинной роли микробиоты кишечника в развитии СРК и изучения основных механизмов, приводящих к дисфункции кишечника. Мы использовали фекальную микробиоту пациентов с СРК-Д и здоровых людей соответствующего возраста и пола для колонизации кишечника стерильных мышей и исследовали их через 4 недели. По сравнению с мышами, получивших микробиоту от здоровых людей, у экспериментальных мышей отмечалось уменьшение времени кишечного транзита, снижение барьерных функций кишечника и развитие микровоспаления [6]. Также у экспериментальных мышей развилось тревожное поведение: предполагается, ч т о т р а н с п л а н т а ц и я м и к р о б и о м а о т пациентов с СРК в организм мыши не только изменяла функцию кишечника, но и нарушала коммуникацию между кишечником и головным мозгом. Эти функциональные нарушения были связаны с изменениями экспрессии многих нейроиммунных генов, а также уровней различных микробных и мышиных метаболитов. Добавление в корм пробиотиков нормализовало кишечный транзит и купировало тревожное поведение у мышей с микробиотой от пациентов с СРК-Д, что ассоциировалось с изменениями профилей микробиоты и выработкой бактериального индола, подтверждая гипотезу о том, что микробиом кишечника играет ключевую роль в коммуникации между кишечником и головным мозгом [7].
Ось кишечник — головной мозг представляет собой двунаправленную систему связи между кишечником и мозгом посредством нейронной, гормональной и иммунологической сигнализации. Все больше данных показывает, что микробиота кишечника играет ключевую роль в коммуникации между желудочно-кишечным трактом и центральной нервной системой, причем большинство данных было получено из исследований на животных [8]. Стерильные мыши демонстрируют аномальное поведение, связанное с изменениями экспрессии множества генов и химических процессов в головном мозге, проницаемости гематоэнцефалического барьера, морфологии различных областей головного мозга, участвующих в контроле настроения и тревожности (миндалевидное тело и гиппокамп), профиля миелинизации и пластичности нейронов, а также диффузными нарушениями микроглии головного мозга. Большинство этих аномалий нормализуются после бактериальной колонизации кишечника. Микробиота также изменяет поведение обычных мышей, поскольку введение антимикробных препаратов, не всасывающихся в кишечника, может повысить у них поисковое поведение наряду с изменением содержания нейротрофический фактор мозга (BDNF) в гиппокампе и миндалевидном теле. Изменения в поведении на фоне применения антибиотиков также были описаны у пациентов, получавших лечение острых инфекций или во время эрадикации хронической инфекции Helicobacter pylori. Это состояние было названо «антибиотик-индуцированный психоз». Интересно, что, по данным недавнего крупного популяционного исследования, использование антибиотиков в раннем детстве было связано с повышенным риском развития психических расстройств в более старшем возрасте.
Однако наиболее очевидные доказательства существования оси кишечник — головной мозг поступают от пациентов с цирроз-ассоциированной печеночной энцефалопатией, которая проявляется изменениями поведения, настроения и когнитивных функций [9]. После приема антибиотиков или слабительных средств у этих пациентов наступает резкое улучшение функций головного мозга, а недавние исследования показали, что аналогичное улучшение также может быть достигнуто путем трансплантации фекальной микробиоты.
В последние годы проведено несколько исследований микробиома кишечника у пациентов с психическими расстройствами, такими как большое депрессивное расстройство и генерализованное тревожное расстройство. Установлены различия микробиологических профилей у пациентов и здоровых людей. Кроме того, перенос микробиоты от пациентов к грызунам без микробов в организме или получавшим антибиотики, вызывал у последних тревожное и депрессивное поведение. В связи с этим возникает вопрос, можно ли применять пробиотики, которые показали благоприятное влияние на поведение и химию мозга в моделях на животных, для лечения пациентов с психическими заболеваниями. Результаты нескольких завершенных исследований свидетельствуют о том, что пробиотики, применяемые в качестве дополнительного лечения, могут улучшить симптомы у некоторых пациентов с большим депрессивным расстройством [10].
Мы провели пилотное рандомизированное контролируемое исследование у пациентов с СРК и сопутствующей депрессией для оценки влияния пробиотика, который оказал благоприятное влияние на поведение и химию головного мозга в нескольких мышиных моделях [11]. Мы обнаружили, что, по сравнению с плацебо, 6-недельное лечение пробиотиками улучшало показатели депрессии и общие симптомы СРК. Это было связано с изменениями активации нейронов в миндалевидном теле и других областях головного мозга, участвующих в контроле настроения, что оценивалось с помощью функциональной магнитно-резонансной томографии. Можно предположить, что некоторые пробиотики способны продуцировать нейроактивные метаболиты, которые можно использовать не только для лечения пациентов с функциональными расстройствами кишечника, но и с психическими нарушениями. Однако, чтобы подтвердить эти результаты, необходимы более строгие клинические исследования.
Синдром раздраженного кишечника — распространенное функциональное желудочно-кишечное расстройство с частыми сопутствующими психическими нарушениями, которое негативно влияет на качество жизни пациентов и оказывает значительное социально-экономическое воздействие. Патофизиология СРК не до конца изучена, но, скорее всего, это мультифакториальное заболевание, в развитии которого не последнюю роль играют нарушения взаимодействия между кишечником и головным мозгом. Микробиота кишечника, по-видимому, играет ключевую роль в развитии СРК, возможно, через взаимодействие с иммунной или нервной системой, хотя точные механизмы этого еще предстоит установить. Бактерии кишечника влияют на поведение и структуру мозга, поэтому некоторые пробиотики могут быть полезны как для лечения дисфункции кишечника, так и нарушений со стороны головного мозга.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016: 150: 1393-407.
2 Black CJ, Ford AC. Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nat Rev Gastroenterol Hepatol 2020; 17: 473-86.
3 Barbara G, Grover M,Bercik P, et al. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology 2019; 156: 46-58.
4 Ford AC, Harris LA, Lacey BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
5 Pittayanon R, Lau JT, Yuan Y, et al. Gut microbiota in patients with irritable bowel syndrome - a systematic review. Gastroenterology 2019; 157: 97-108.
6 De Palma G, Lynch MD, Lu J, et al. Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice. Sci Transl Med 2017; 9: eaaf6397.
7 Constante M, De Palma G, Lu J, et al. Saccharomyces boulardii CNCM I-745 modulates the microbiota-gut-brain axis in a humanized mouse model of irritable bowel syndrome. Neurogastroenterol Motil 2021; 33: e13985.
8 Morais LH, Schreiber HL, 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol 2021; 19: 241-55.
9 Acharya C, Bajaj JS. Chronic liver diseases and the microbiome-translating our knowledge of gut microbiota to management of chronic liver disease. Gastroenterology 2021; 160: 556-72.
10 Nikolova VL, Cleare AJ, Young AH, Stone JM. Updated review and meta-analysis of probiotics for the treatment of clinical depression: adjunctive vs. stand-alone treatment. J Clin Med 2021; 10: 647.
11 Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology 2017; 153: 448-59.

