МИКРОБИОТА КИШЕЧНИКА #12
Проф. Маркку Воутилайнен (Markku Voutilainen)
Медицинский факультет Университета Турку; Университетская больница Турку, отделение гастроэнтерологии, Турку, Финляндия

ТРАНСПЛАНТАЦИЯ ФЕКАЛЬНОЙ МИКРОБИОТЫ МЛАДЕНЦАМ, РОДИВШИМСЯ ПРИ ПОМОЩИ КЕСАРЕВА СЕЧЕНИЯ, ДЛЯ ВОССТАНОВЛЕНИЯ НОРМАЛЬНОЙ МИКРОБИОТЫ КИШЕЧНИКА
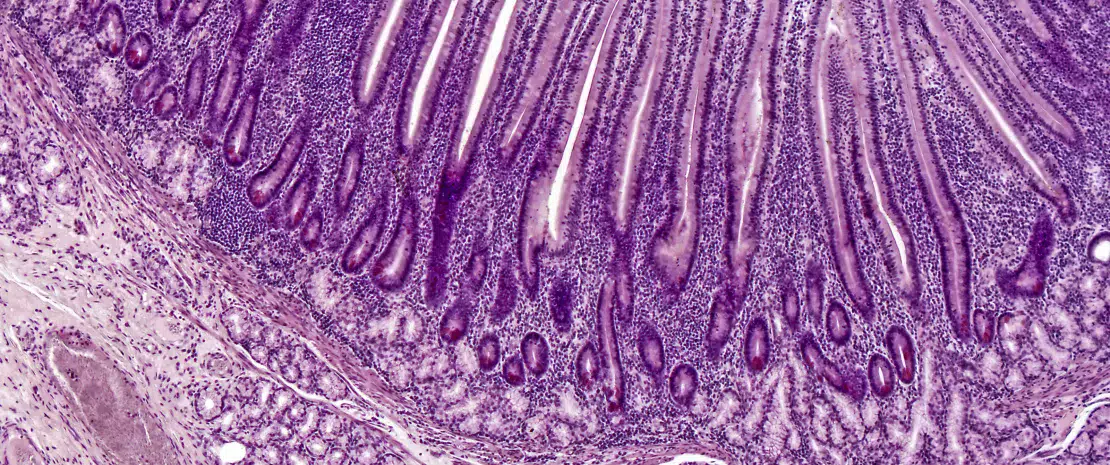
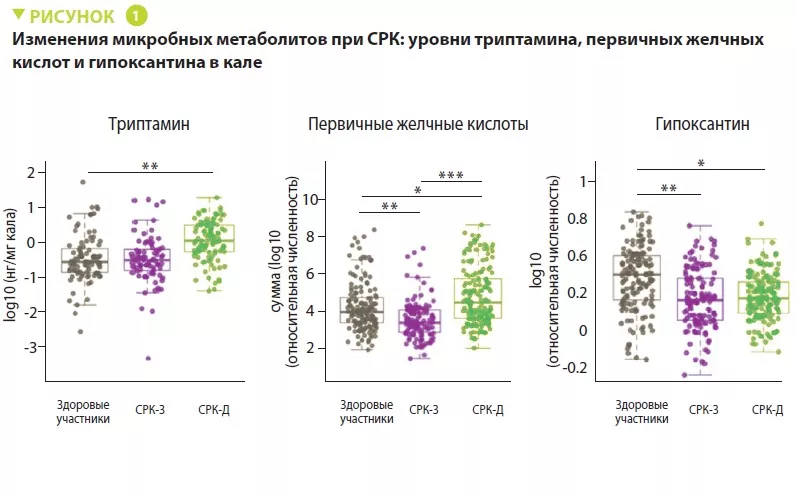
Микробиота кишечника младенцев, родившихся естественным путем, отличается от микробиоты кишечника младенцев, родившихся при помощи кесарева сечения (КС), поскольку последние не подвергаются воздействию материнских микробов во время родов. В нескольких исследованиях сообщалось, что КС может быть иметь краткосрочные и долгосрочные последствия, включая повышенный риск хронических иммунных заболеваний. В этом исследовании оценивали эффективность и безопасность трансплантации фекальной микробиоты (ТФМ) как средства восстановления кишечной микробиоты детей, родившихся при помощи КС. Семи младенцам, родившимся при помощи КС, выполнена трансплантация кала собственных матерей при первом кормлении молоком; состав микробиоты их кишечника сравнили с составом микробиоты кишечника 82 детей, родившихся вагинально или при помощи КС, но не получавших ТФМ. В течение 3-месячного наблюдения нежелательных эффектов не обнаружено. Через неделю после ТФМ микробиота кишечника детей, родившимся при помощи КС, была аналогична микробиоте детей, родившихся естественным путем, в то время как у детей, родившимся при помощи КС, но не получавших ТФМ, обнаружено более низкое микробное разнообразие. ТФМ корректировала бактериальную сигнатуру новорожденных, родившихся при помощи КС, за счет быстрой нормализации содержания Bacteroidales, которое было ниже в группе КС, а также уменьшения количества потенциальных патогенов, типичных для детей, родившихся при помощи КС. Это экспериментальное исследование показало, что ТФМ нормализует развитие кишечной микробиоты у детей, родившихся при помощи КС.
КЕСАРЕВО СЕЧЕНИЕ И РИСК БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Авторы проанализировали влияние кесарева сечения (КС) на состав микробиоты кишечника в течение первого года жизни и изучили, были ли его нарушения связаны с риском развития бронхиальной астмы в первые 6 лет жизни. В их числе 700 детей из когорты COPSAC2010 (Копенгагенские проспективные исследования бронхиальной астмы в детском возрасте 2010 г.), 22% (151) из которых родились при помощи КС, а 78% (549) — естественным путем. Состав кишечной микробиоты варьировался в зависимости от способа родоразрешения: у детей, рожденных при помощи КС, обнаружено более низкое содержание бактерий Bacteroidetes и Actinobacteria в возрасте 1 недели, а содержание бактерий Firmicutes и Proteobacteria было выше по сравнению с детьми, рожденными естественным путем.
При анализе на уровне рода бактерий обнаружено, что только 3 рода различались в возрасте 1 года, а рождение при помощи КС было связано с более высокой относительной численностью организмов семейства Enterobacteriaceae и Escherichia/Shigella. Идентифицирован микробный профиль, который был предиктором способа родов, в возрасте одной недели, одного месяца и одного года. У детей, родившимся при помощи КС, которые сохранили характерную для КС сигнатуру микробиоты кишечника в возрасте 1 года, риск развития бронхиальной астмы к 6 годам был в три раза выше.
Этот повышенный риск бронхиальной астмы снижался у детей, родившимся при помощи КС, кишечная микробиота которых в возрасте 1 года напоминала микробиоту детей, родившихся естественным путем. Это указывает на то, что здоровое созревание дисбиотической микробиоты кишечника после КС может снизить риск бронхиальной астмы, связанный с этим способом родоразрешения.