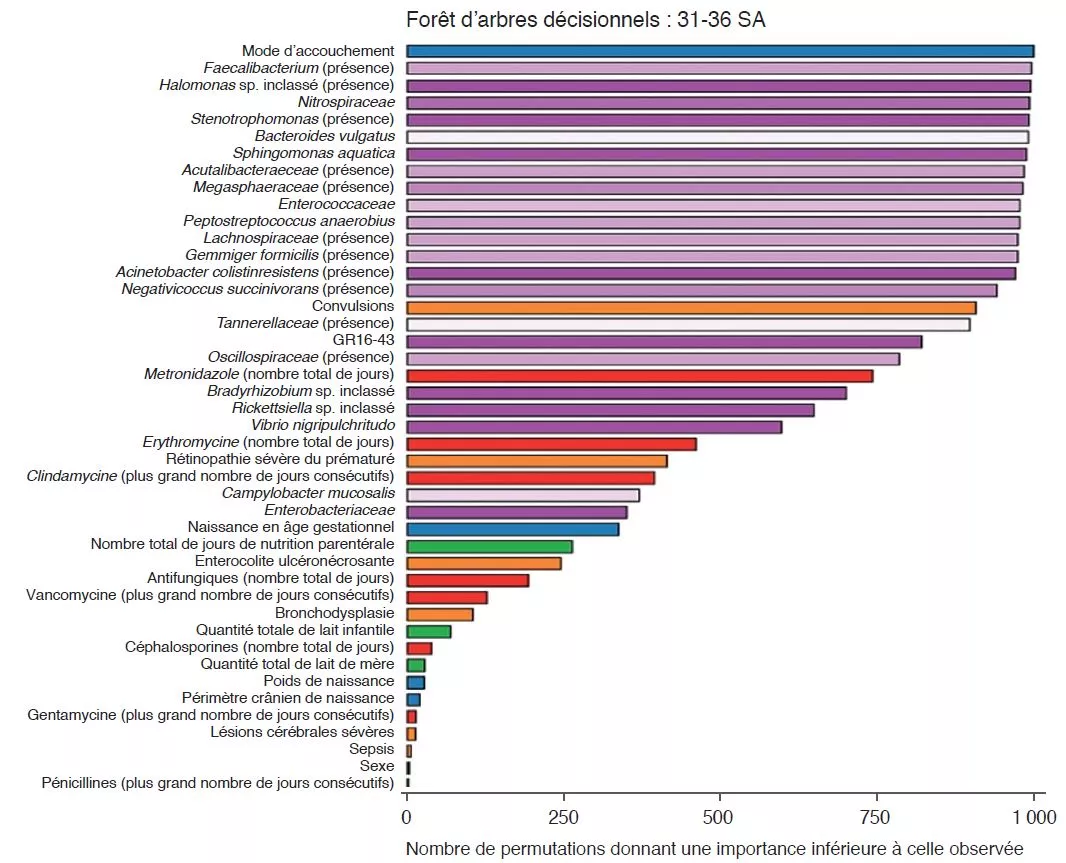
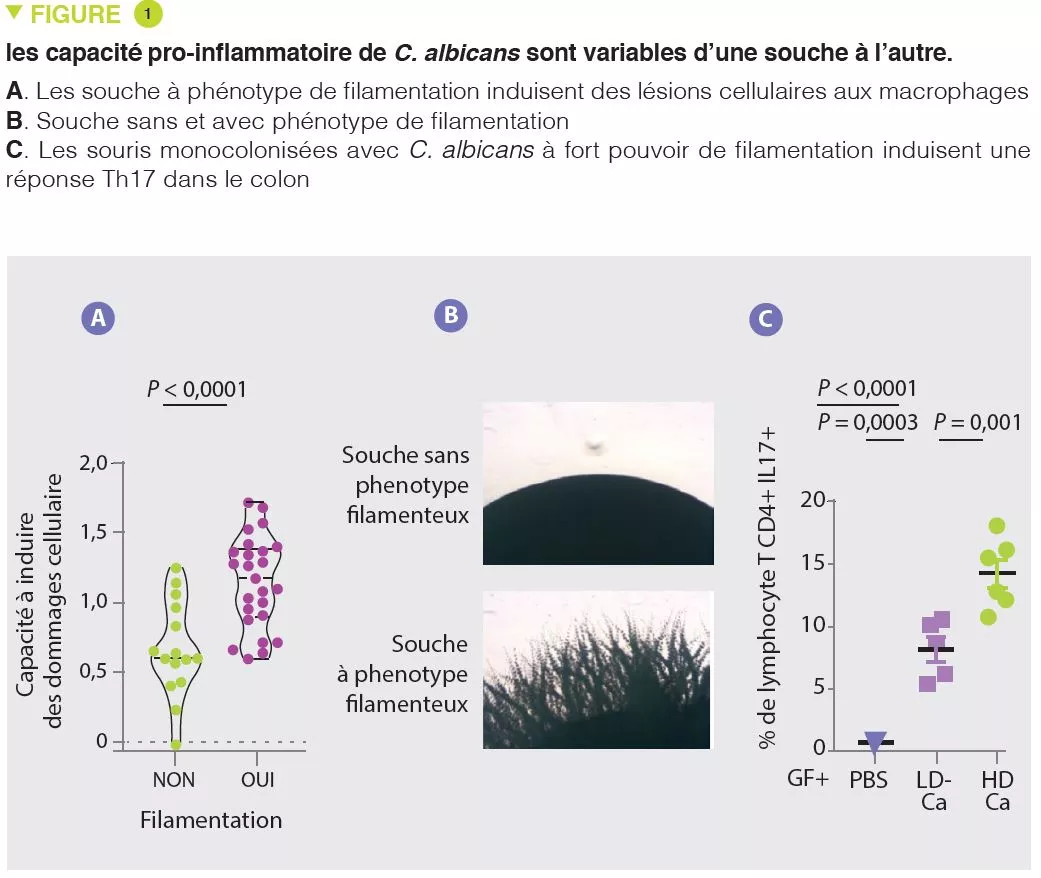
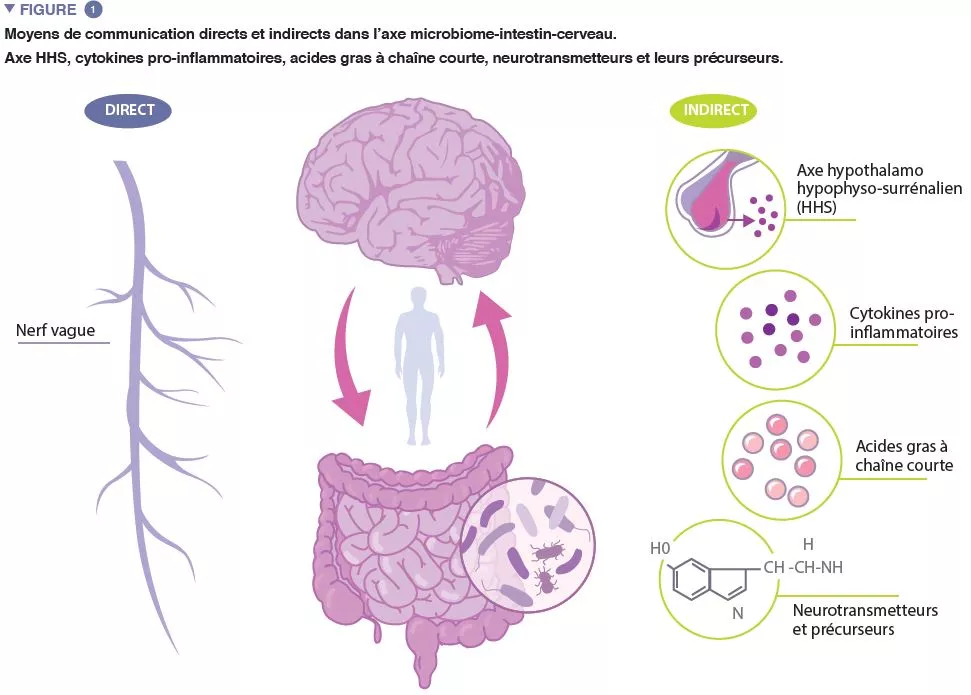
Microbiote intestinal # 16
Par le Pr. Satu Pekkala
Chercheur à l’Académie de Finlande, Faculté des sciences du sport et de la santé, Université de Jyväskylä, Finlande
ASSOCIATIONS INTER-COHORTES ENTRE LE MICROBIOME INTESTINAL ET LA RÉPONSE AUX INHIBITEURS DE POINT DE CONTRÔLE IMMUNITAIRE DANS LE MÉLANOME AVANCÉ
Les inhibiteurs de point de contrôle immunitaire (ICI) ont considérablement amélioré le traitement du mélanome avancé. Toutefois, les patients ne répondent pas tous au traitement, ce qui pourrait être lié au microbiote intestinal. Lee et al. ont réalisé un séquençage métagénomique shotgun d’échantillons fécaux provenant de cinq cohortes européennes naïves d’ICI, comprenant au total 165 patients atteints de mélanome cutané avancé. En raison des différences cliniques et mutationnelles entre les cohortes, celles-ci ont été analysées séparément et n’ont pas été regroupées. Les auteurs ont trouvé une différence significative dans la composition du microbiote intestinal entre les répondeurs et les non-répondeurs dans la cohorte PRIMM-UK, mais pas dans la cohorte PRIMM-Netherland (NL). De plus, en analysant les bases de données accessibles au public (n = 147 échantillons métagénomiques), il est clairement apparu que la reproductibilité des prédictions de réponse entre les cohortes était limitée. Aucune bactérie unique n’était un biomarqueur parfaitement constant de la réponse aux ICI dans tous les ensembles de données. Toutefois, un panel d’espèces microbiennes, incluant Bifidobacterium pseudocatenulatum, Roseburia spp. et Akkermansia muciniphila, a été identifié dans l’étude comme étant associé aux répondeurs. En ce qui concerne les gènes fonctionnels du microbiote, par exemple l’ADN adénine méthylase, ils étaient augmentés chez les répondeurs. En conclusion, bien qu’un panel potentiel de biomarqueurs microbiens montrant la réactivité au traitement par ICI ait été identifié, des études futures sur des cohortes plus vastes sont nécessaires. En outre, plusieurs facteurs cliniques doivent être considérés comme étant des facteurs de confusion lors de l’évaluation des biomarqueurs qui pourraient être utiles pour le diagnostic.
AKKERMANSIA MUCINIPHILA INTESTINAL PRÉDIT LA RÉPONSE CLINIQUE AUX ANTI-PD-1 CHEZ LES PATIENTS ATTEINTS D’UN CANCER DU POUMON NON À PETITES CELLULES AVANCÉ
De nombreux patients atteints d’un cancer du poumon non à petites cellules (CPNPC) ne répondent pas au traitement par inhibiteurs de checkpoint (ICI), tels que les anti-PD-1. Des preuves récentes montrent que certains membres du microbiote intestinal, en particulier Akkermansia muciniphila, peuvent influencer l’efficacité des ICI chez les patients atteints de CPNPC. De plus, la résistance au traitement a été associée à un microenvironnement tumoral moins inflammatoire. L’étude prospective multicentrique de Derosa et al. a inclus 338 patients atteints de CPNPC avancé traités par ICI afin de déterminer si les profils métagénomiques du microbiote intestinal pouvaient expliquer la réponse au traitement. Ils ont montré qu’une plus grande abondance d’Akkermansia dans les échantillons fécaux initiaux était associée à un taux de réponse plus élevé au traitement par ICI, lui-même étant associé à un bénéfice clinique (augmentation de la survie). De plus, la présence d’Akkermansia était associée à d’autres modifications du microbiote intestinal potentiellement pertinentes pour le pronostic. Plusieurs gènes tumoraux exprimés de manière différentielle étaient liés à la réponse aux anti-PD-1, ce qui suggère qu’Akkermansia pourrait favoriser la migration des lymphocytes T auxiliaires vers le microenvironnement tumoral. Afin de démontrer avec certitude qu’Akkermansia pourrait surmonter la résistance aux ICI, les auteurs ont inoculé deux souches différentes d’A. muciniphila à des souris qui avaient préalablement bénéficié d’une transplantation de microbiote fécal issu d’un patient résistant aux anti-PD-1. Par rapport aux souris témoins, les deux souches ont permis de restaurer la réponse au traitement. Cette étude est de loin la plus vaste analyse métagénomique prospective ayant validé Akkermansia comme facteur pronostique potentiel pour les patients atteints de CPNPC traités par ICI et démontré le potentiel mécaniste d’Akkermansia.
TRANSPLANTATION DE MICROBIOTE FÉCAL POUR LES TROUBLES BIPOLAIRES : UNE ÉTUDE DE CAS DÉTAILLÉE
La seule indication approuvée de la TMF est l’infection récurrente à Clostridioides difficile. Toutefois, l’implication du microbiote intestinal dans de nombreuses autres maladies (la maladie de Parkinson, par exemple) suggère que les indications de la TMF pourraient bientôt être élargies. Le microbiote intestinal peut également modifier de nombreux processus associés à la dépression, comme l’axe hypothalamo-hypophyso-surrénalien. Aucun essai publié n’avait jusqu’à présent utilisé la TMF pour traiter des patients souffrant de troubles bipolaires. L’étude longitudinale de Parker et al. présente le cas d’un homme de 28 ans souffrant de troubles bipolaires. À l’âge de 10 ans, il a développé des épisodes dépressifs. Les symptômes comprenaient une humeur sévèrement dépressive, des pensées suicidaires, une anergie, des troubles de la concentration, un retard psychomoteur et une insomnie. Ces symptômes étaient fréquemment associés à de l’irritabilité et de l’anxiété. À l’âge de 15 ans, il a développé son premier épisode hypomaniaque. Pendant des années, il a été traité avec succès par des médicaments, mais les troubles thymiques sont réapparus. Il a volontairement commencé à prendre des probiotiques (souches de Lactobacillus Saccharomyces). Après la prise des probiotiques, il a lui-même signalé un énorme soulagement de ses symptômes. Encouragé par ces améliorations, le patient a lu des articles sur les recherches relatives au microbiome et décidé d’essayer la TMF. Cette procédure a été pratiquée par coloscopie par un gastro-entérologue. Après la TMF, le patient a noté ses états d’humeur pendant 470 jours consécutifs. Il a lui-même signalé que les épisodes thymiques avaient diminué en fréquence et en sévérité au fil des mois. Il a également pu réduire considérablement son traitement médicamenteux. Douze mois après la TMF, il a déclaré avoir des épisodes maniaques distincts, pratiquement aucun symptôme bipolaire et une amélioration des symptômes du trouble du déficit de l’attention avec hyperactivité. Bien qu’il ne s’agisse que d’une étude de cas, la TMF a permis de réduire les symptômes bipolaires, ce qui justifie la nécessité de mener des études sur la TMF dans des cohortes bipolaires plus importantes.