ЛЕЧЕНИЕ БОЛЕЗНИ КРОНА В АКТИВНОЙ СТАДИИ С ПОМОЩЬЮ ОБЫЧНОЙ ДИЕТЫ, КОТОРАЯ ВОСПРО- ИЗВОДИТ ИСКЛЮЧИТЕЛЬНО ЖИДКОЕ ЭНТЕРАЛЬНОЕ ПИТАНИЕ
РЕЦЕНЗИИ - РАЗДЕЛ «ДЕТИ»
Автор: проф. Эммануэль Мас (Emmanuel Mas)
Отделение гастроэнтерологии и питания, Детская больница, Тулуза, Франция

Комментарии к оригинальной публикации Сволос и соавт. (Svolos et al.) (Gastroenterology 2019)
Исключительно жидкое энтеральное питание (ИЖЭП) является единственной признанной диетотерапией при болезни Крона (БК), но его переносимость имеет ограничения. Существует потребность в новой диетотерапии болезни Крона.
Действие персонализированной диеты (CD-TREAT), основанной на составе ИЖЭП, оценивали с помощью анализа микробиоты кишечника, воспаления и клинического ответа у крыс, у здоровых взрослых и у детей с рецидивирующей болезнью Крона
В конечном итоге было показано, что питание CD-TREAT повторяет изменения ИЖЭП в микробиоте кишечника, уменьшает воспаление кишечника, хорошо переносится и является потенциально эффективным у пациентов с болезнью Крона в активной стадии
ЧТО УЖЕ ИЗВЕСТНО ПО ДАННОЙ ТЕМЕ?
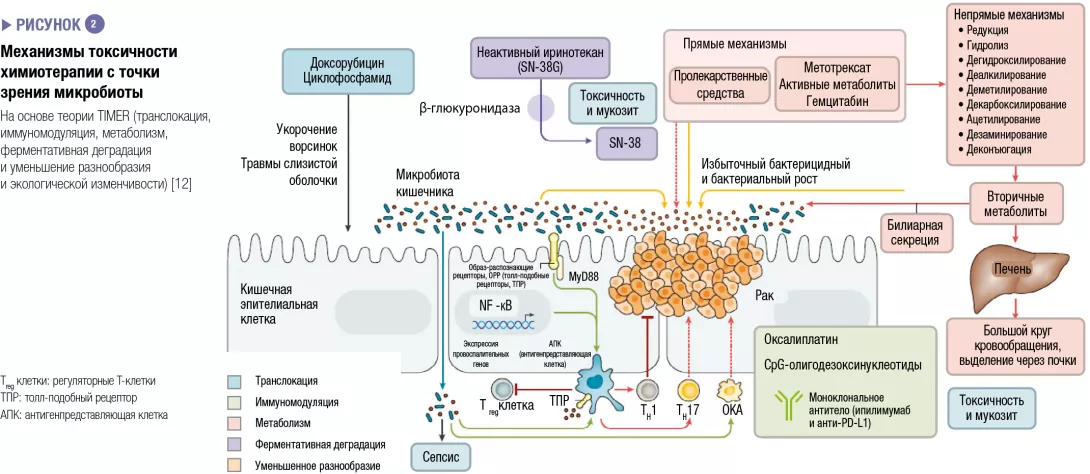
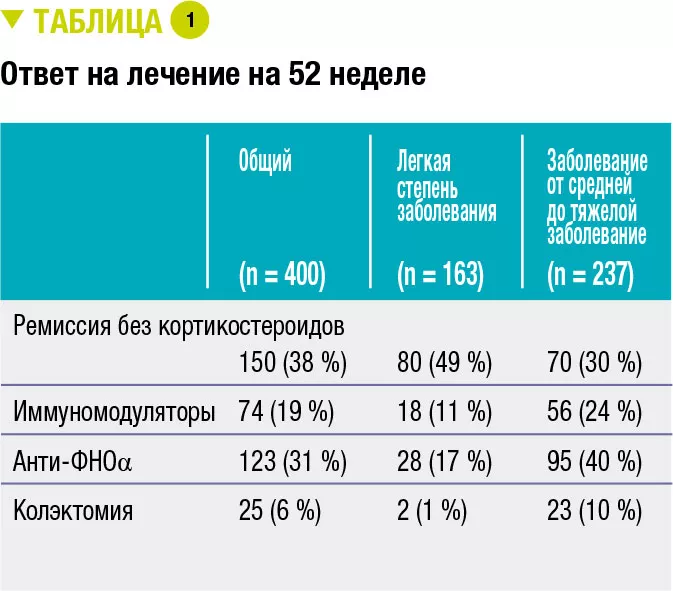
Исключительно жидкое энтеральное питание (ИЖЭП) является эффективным лечением болезни Крона с поражением подвздошной кишки, достигающим хороших результатов (заживление слизистой оболочки в 80 % случаев), которые превосходят результаты, полученные при кортикостероидной терапии. Тем не менее основным препятствием является переносимость введения жидкого энтерального питания в течение не менее 8 недель. ИЖЭП поступает через назогастральный зонд или, как в случае Modulen IBD®, пероральным путем. Механизм действия ИЖЭП до конца не изучен, но некоторые исследования предполагают, что оно действует путем модуляции микробиоты кишечника.
КАКОВЫ ОСНОВНЫЕ РЕЗУЛЬТАТЫ ЭТОГО ИССЛЕДОВАНИЯ?
Это исследование было направлено на то, чтобы определить, может ли быть эффективной при болезни Крона обычная диета (CD-TREAT), т. е. пероральный прием обычной пищи, основанный на составе питательных веществ, аналогичном составу Modulen IBD®. Доля углеводов была снижена, а доля белка увеличена. Таблетки с мультивитаминами содержали питательные микроэлементы из ИЖЭП.
Перекрестное исследование было проведено с участием 25 здоровых взрослых добровольцев, которые получали CD-TREAT или ИЖЭП в течение одной недели с периодом вымывания между ними. Диета CD-TREAT была более удобной для пациентов и более калорийной, чем ИЖЭП. Эти диеты не изменили богатство и альфа-разнообразие микробиоты. Однако относительная численность родов бактерий значительно изменилась после приема ИЖЭП и CD-TREAT: соответственно, 58 (49,3 %) и 38 (32,3 %), из которых 28 изменились в одном и том же направлении. Наблюдались изменения концентрации разных метаболитов (концентрации некоторых короткоцепочечных жирных кислот – ацетата, пропионата и бутирата – значительно снизились после приема ИЖЭП и CD-TREAT), а значение pH кала увеличилось примерно на 1 еди- ницу.
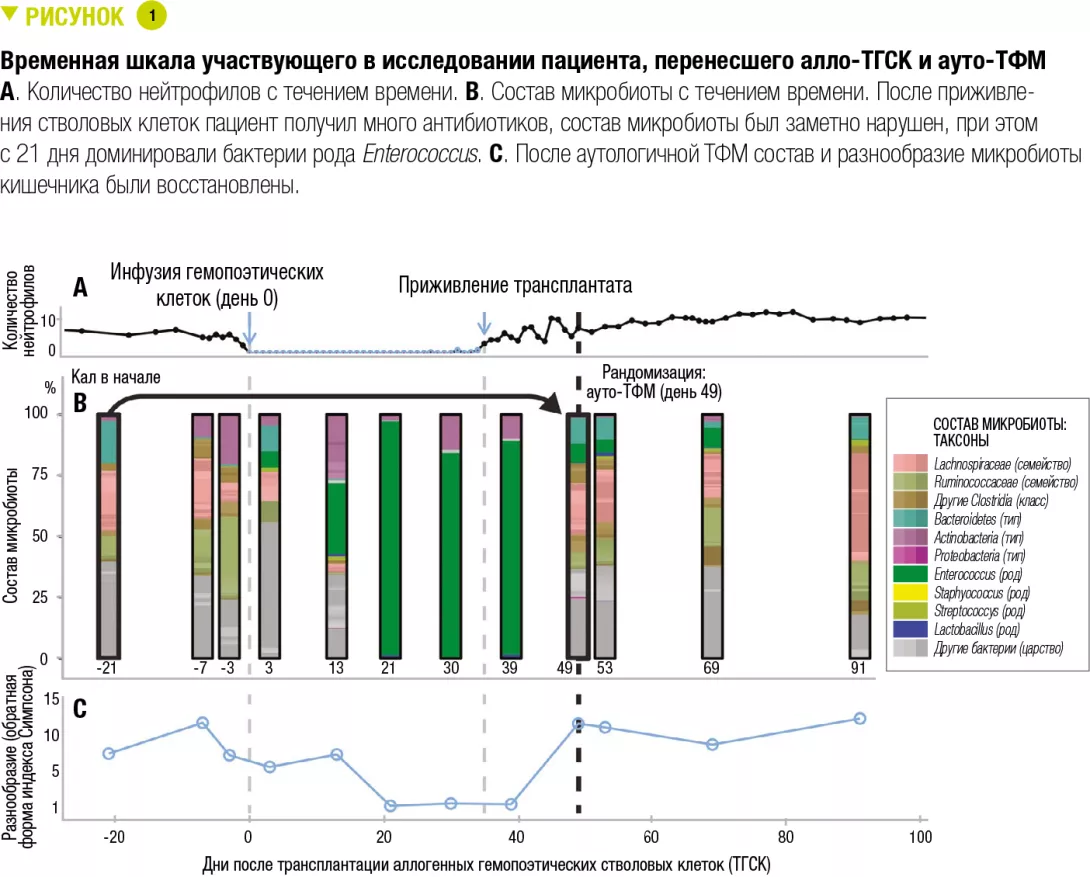
Эксперименты на животных проводили с участием 5 групп крыс, HLA B27 (с воспалением) и B7 (без воспаления): B27-ИЖЭП, B27-CD-TREAT, B27-CONTROL, B7-ИЖЭП и B7-CONTROL. В результате применения диеты ИЖЭП и CD-TREAT уменьшилось воспаление подвздошной кишки (рисунок 1А), экспрессия IL-6 была ниже в группе B27-CD-TREAT по сравнению с группой B27-CONTROL (p = 0,036). После 4-недельного вмешательства бактериальное разнообразие было выше в слепой кишке (рисунок 1B) и в фекалиях в группах B27-CD-TREAT и B27-ИЖЭП по сравнению с группой B27-CONTROL. В результате применения обеих диет наблюдались изменения концентрации некоторых короткоцепочечных жирных кислот в кале.
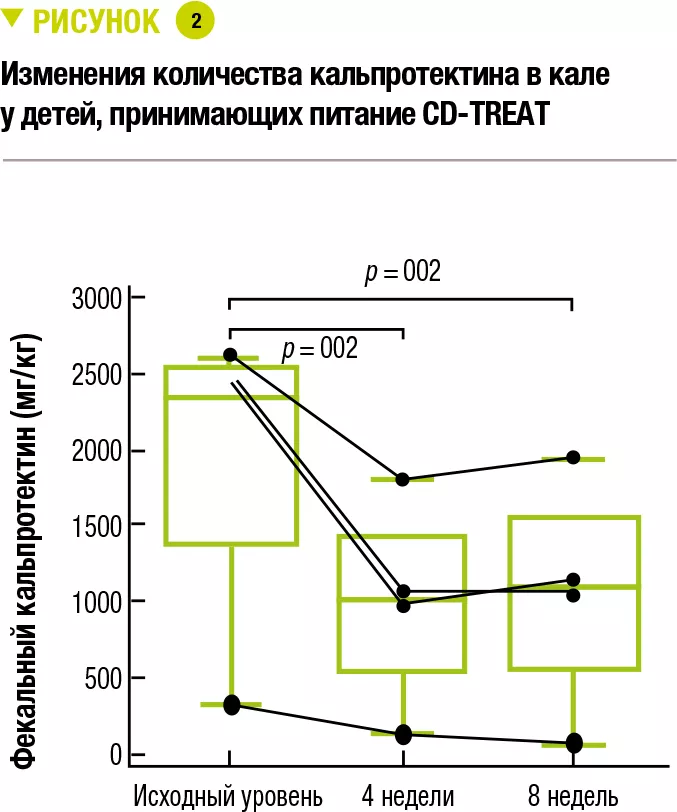
В заключение 5 детей с легкой и умеренной степенью тяжести болезни Крона (величина скорректированного педиатрического индекса активности БК (wPCDAI) 22,5–42,5) получали лечение CD-TREAT в течение 8 недель. Один ребенок прекратил участие в исследовании через 9 дней из-за обострения симптомов. Через 4 недели у 3 детей (60 %) наблюдался клинический ответ (изменение величины индекса wPCDAI > 17,5) и у 2 детей (40 %) наблюдалась клиническая ремиссия (величина индекса wPCDAI < 12,5). Через 8 недель у 80 % детей (у 4 из 5) наблюдался клинический ответ, а у 60 % (у 3 из 5) наблюдалась клиническая ремиссия. Средний базовый уровень кальпротектина в кале 1960 мг/кг снизился, соответственно, на 53 % и 55 % через 4 и 8 недель (рисунок 2). Количество кальпротектина снизилось до нормы только у одного ребенка.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
-
При болезни Крона подходящее пероральное питание может быть столь же эффективным, что и исключительно жидкое энтеральное питание
-
Его действие на микробиоту кишечника имитирует действие исключительно жидкого энтерального питания
-
Оно предлагает альтернативу жидкому энтеральному питанию, которое плохо
КАКОЕ ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ ИМЕЮТ ЭТИ РЕЗУЛЬТАТЫ?
Настоящее исследование демонстрирует, что эта диета является более пригодной при пероральном введении и что она повторяет действие ИЖЭП с Modulen IBD® на микробиоту кишечника. Питание CD-TREAT также улучшает клинические симптомы и уменьшает воспаление кишечника
ЗАКЛЮЧЕНИЕ
Это исследование подтверждает концепцию, что новая и лучше переносимая диетотерапия может быть эффективной при лечении болезни Крона. Эти результаты должны быть подтверждены в крупных контролируемых рандомизированных клинических исследованиях