Как избавиться от воспаления желудочно- кишечного тракта — с помощью диеты
Доктор Джинелл Хили

Есть много способов повлиять на состав микробиоты кишечника и модулировать иммунный ответ (пребиотики, пробиотики...)31. Один из вариантов — коррекция диеты, которая потенциально может изменить активность местной иммунной системы, ослабляя повышенный воспалительный тонус. Такой подход называется иммунопитанием32. К числу самых изучаемых иммунонутриентов относятся омега-3 полиненасыщенные жирные кислоты, витамин D, аргинин, нуклеотиды и глутамин32.
Источники витамина D
- жирная рыба, масло из печени трески
- яйца, грибы
- обогащенные продукты: молочные продукты, зерновые, заменители молока (например, соевое молоко)
- образование в коже под воздействием солнечных лучей39
Витамин d и его влияние на иммунную систему кишечника
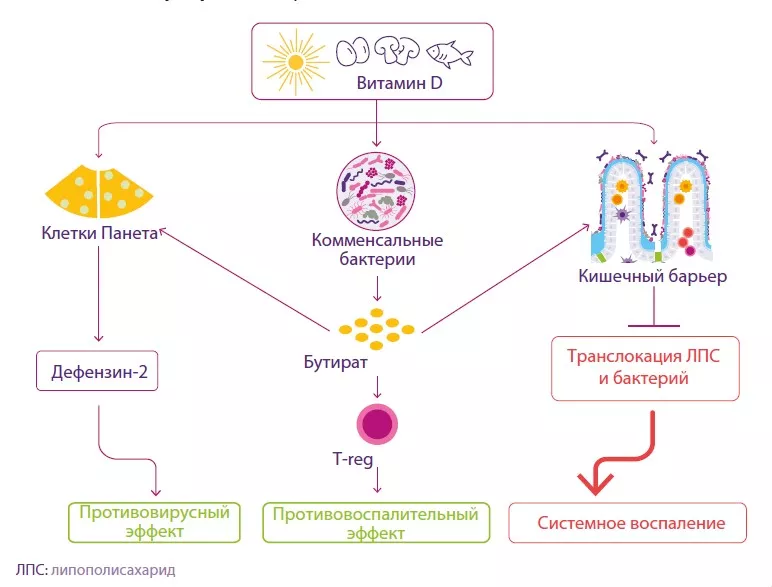
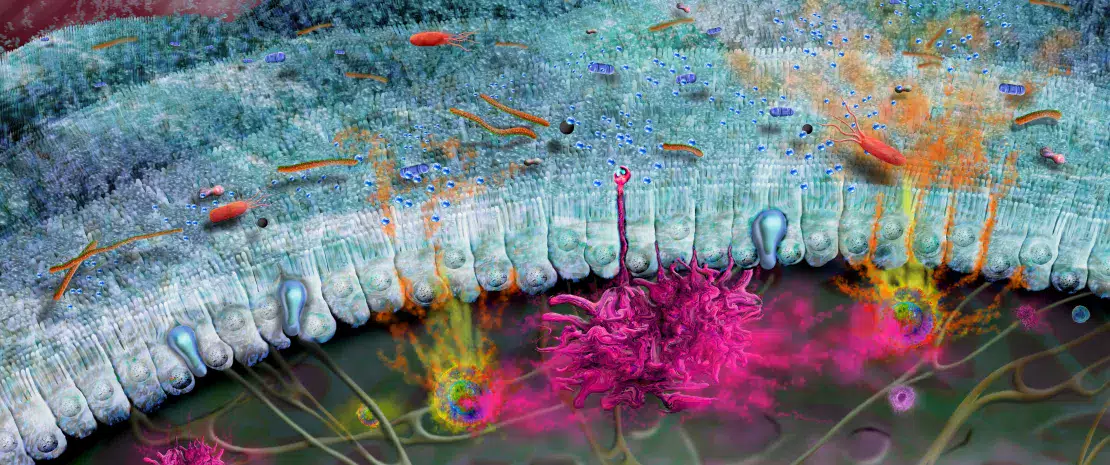
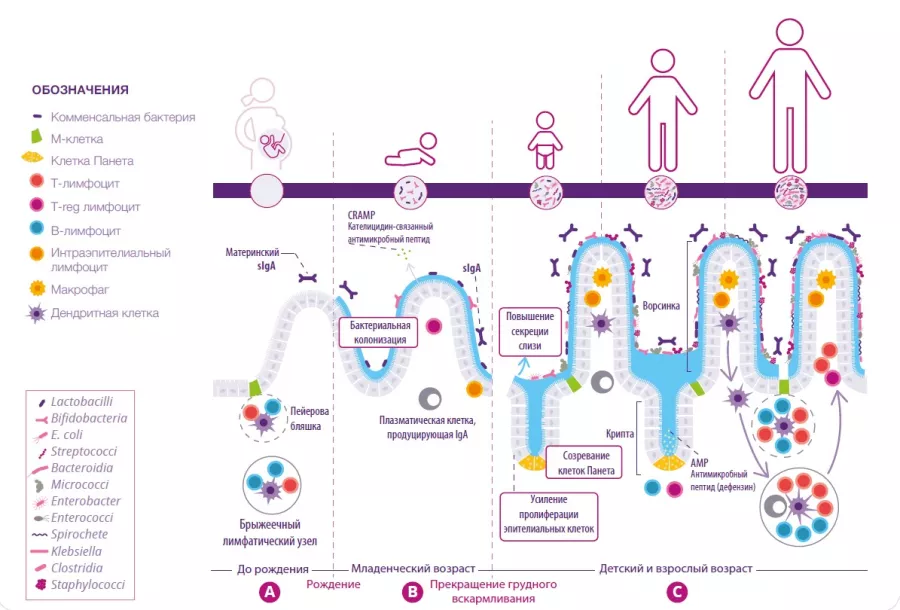
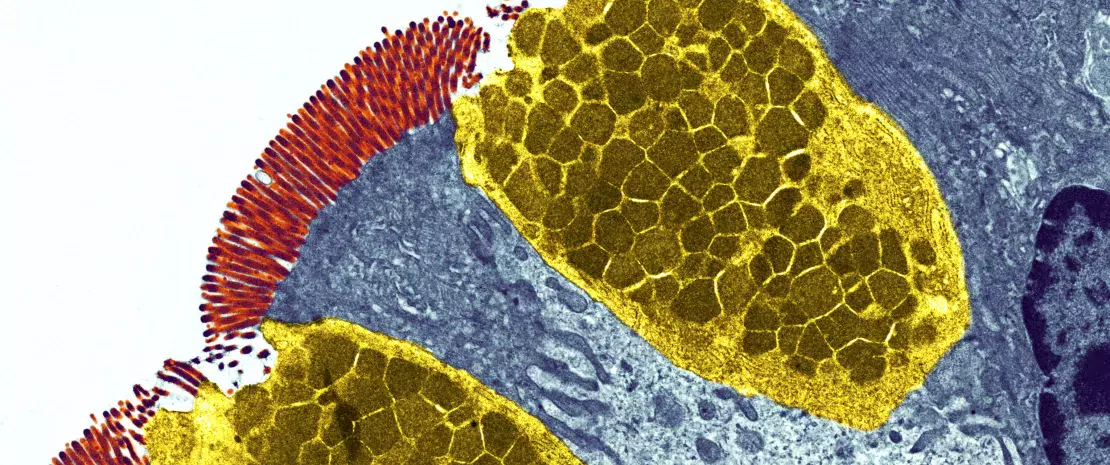
Хотя самой изученной функцией витамина D считается его роль в контроле уровня кальция и поддержании здоровья костей, также известно, что он оказывает значительное влияние на иммунные ответы со стороны ЖКТ. Витамин D регулирует функцию нескольких генов, которые контролируют барьерную функцию кишечника, а также генов, кодирующих антимикробные пептиды, тем самым помогая поддерживать кишечный баланс (рисунок 5)33. Он оказывает иммуномодулирующее действие, включая дифференцировку иммунных клеток, миграцию и противовоспалительные функции34, и может действовать непосредственно на клетки Панета, стимулируя секрецию дефензина-235. Витамин D также способствует увеличению разнообразия состава кишечной микробиоты, что приводит к увеличению продукции бутирата. Бутират может оказывать противовоспалительное действие, повышать барьерную функцию кишечника и стимулировать клетки Панета к выделению дефензинов (рисунок 5). Интересно, что некоторые пробиотические бактерии (например, штаммы Lactobacillus) повышают уровень витамина D в крови36.
РИСУНОК 5. Влияние витамина D на клетки кишечника, микробиоту и кишечный барьер
По материалам Chen J et al, 2021.37
38 Roseland JM, Phillips KM, Patterson KY, et al. Vitamin D in foods: An evolution of knowledge. Pages 41-78 in Feldman D, Pike JW, et al, eds. Vitamin D, Vol 2: Health, Disease and Therapeutics, 4th Ed. Elsevier, 2018.