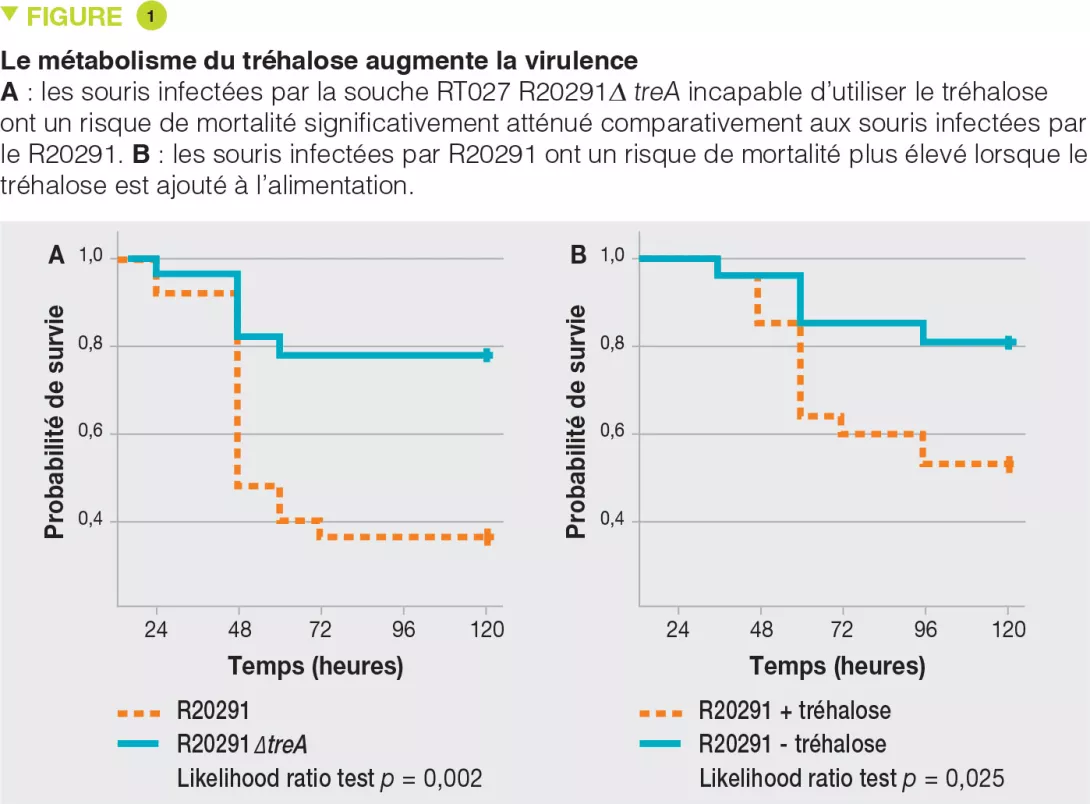
Retour sur la 51e réunion annuelle espghan
Retour de congrès
Par le Dr. Solange Heller Rouassant
Gastroentérologie et nutrition pédiatriques, Mexico City, Mexique Conseiller mexicain de la NASPGHAN

Microbiote gastrique et Helicobacter pylori
Les Proteobacteria, les Firmicutes, les Actinobacteria, les Bacteroidetes et les Fusobacteria sont les phyla les plus abondants chez les patients positifs et négatifs pour H. pylori, et ce microbiote gastrique pourrait jouer un rôle dans la cancérogénicité associée à H. pylori [1]. Alarcón [2] a caractérisé le microbiote gastrique chez des enfants positifs et négatifs pour H. pylori ; lorsqu’elle était présente, H. pylori dominait la communauté microbienne, mais en son absence, la richesse et la diversité bactériennes étaient plus importantes.
Microbiote intestinal en début de vie
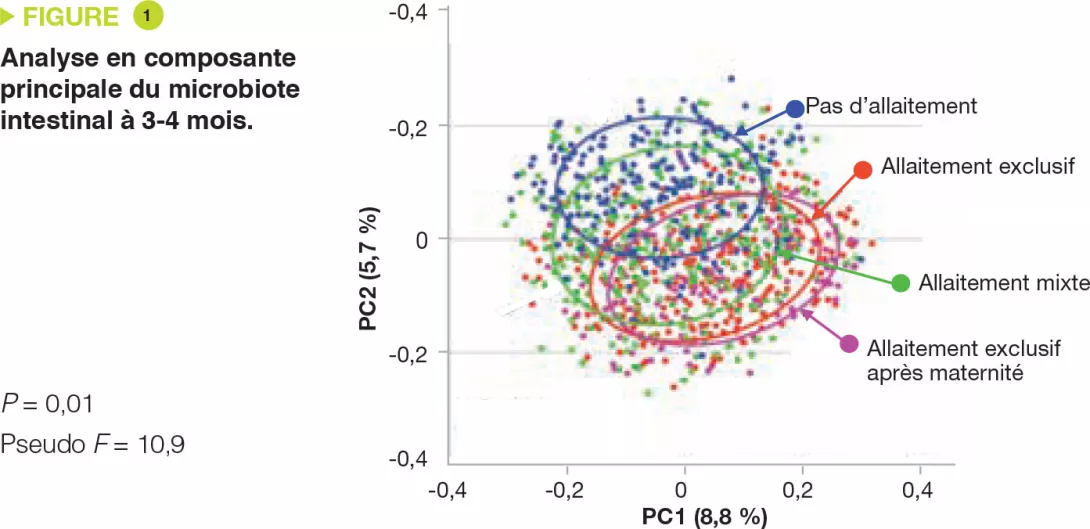
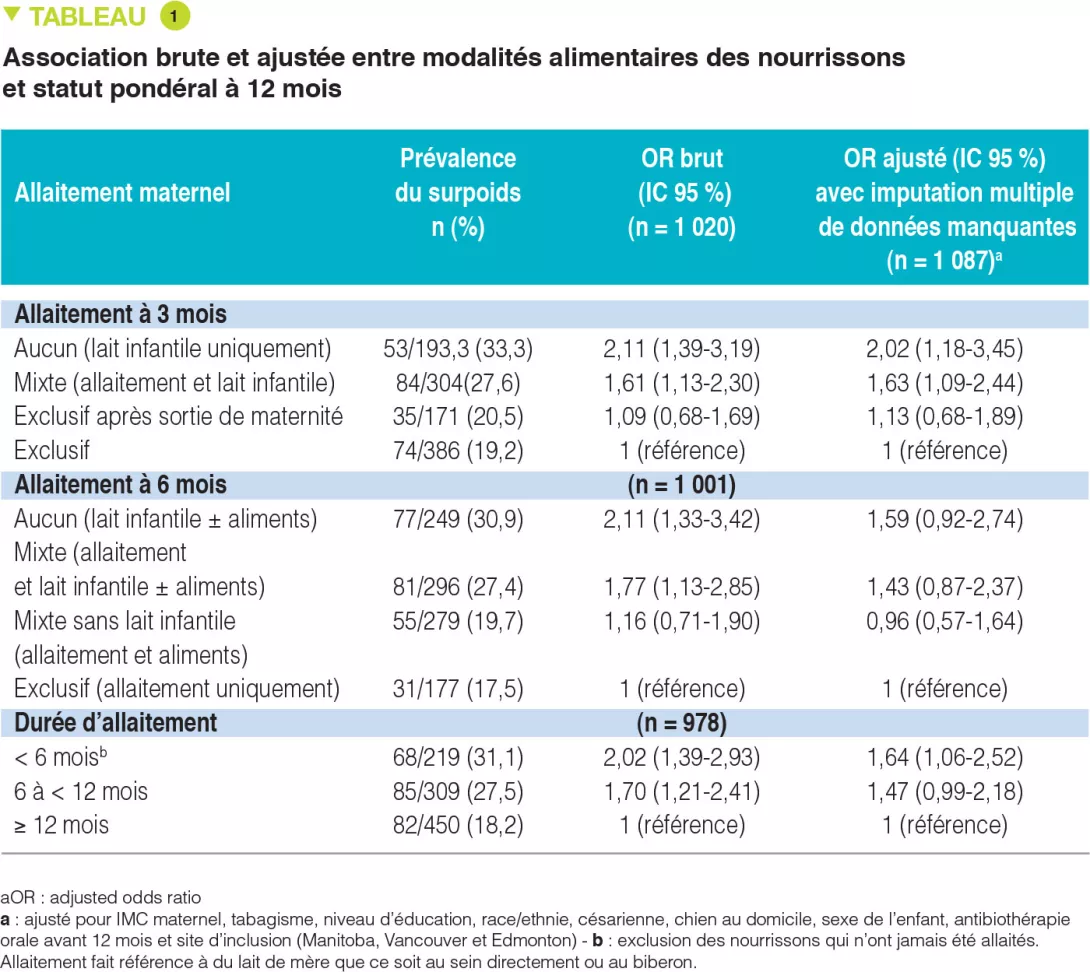
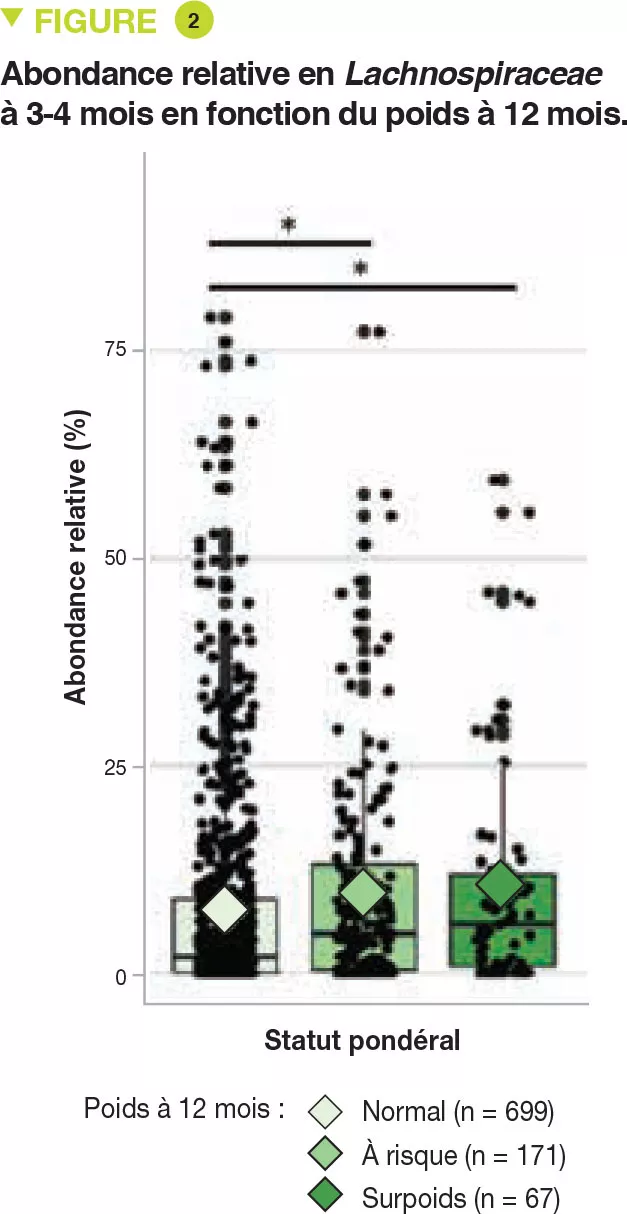
Le développement du microbiote intestinal en début de vie est influencé par le mode d’accouchement, l’alimentation (lait maternel ou lait infantile), le recours aux antibiotiques, le moment de l’introduction des aliments solides et l’arrêt de l’alimentation lactée. Le microbiote intestinal d’un nouveau-né est dominé de manière transitoire par les entérobactéries et les staphylocoques et très rapidement par les Bifidobacterium et les bactéries lactiques. Les Bifidobacterium sont majoritaires jusqu’à l’introduction d’une alimentation complémentaire [3].
- Dukanovic [4] a montré qu’on retrouvait peu de Bacteroides dans les selles des nourrissons nés par césarienne et exclusivement allaités. Les espèces de Bacteroides ont été détectées dans respectivement 73 % et 16 % des échantillons obtenus lors d’un accouchement par voie basse et par césarienne.
- Collado [4] a démontré que le microbiote du couple mère-enfant et le microbiote du lait maternel présentaient des caractéristiques communes, ce qui suggère une transmission microbienne pendant l’allaitement.
Certaines souches des genres Bacteroides, Bifidobacterium, Staphylococcus et Enterococcus ont été isolées de l’intestin des mères et des nourrissons, et certaines souches de Staphylococcus, Lactobacillus, Enterobacter et Acinetobacter ont été isolées du lait maternel apparié à l’âge de 2 mois.
Supplémentation en probiotiques et en symbiotiques en début de vie
-
Il a été prouvé qu’un lien entre la composition du microbiote intestinal en début de vie et le développement de maladies existait [5]. Des études menées sur le microbiote intestinal de nourrissons en tout début de vie ont montré que le transfert de gènes de résistance aux antibiotiques est acquis précocement et peut laisser des séquelles à long terme.
-
Des nourrissons exclusivement allaités ont reçu une supplémentation avec Bifidobacterium longum subsp. infantis (Casaburi [4]), un probiotique ciblé capable de remodeler le microbiote intestinal avec une réduction potentielle des réservoirs de gènes de résistance aux antibiotiques. Il a été conclu que la colonisation par des taux élevés de cette souche est une méthode sûre et non invasive pour réduire un réservoir de gènes qui confèrent une résistance aux antibiotiques.
-
Les taux élevés de Bifidobacterium longum subsp. infantis chez les nourrissons allaités, quel que soit le mode d’accouchement, restaient stables au cours de la première année de vie si l’allaitement était poursuivi [4].
Supplémentation du lait maternisé en prébiotiques et en probiotiques
Les oligosaccharides contenus dans le lait maternel (OLM) sont des composés du lait maternel non conjugués, solides et abondants. Le spectre des OLM contenus dans le lait maternel, principalement lié au statut sécréteur de la mère, module la composition bifidobactérienne de l’intestin des nourrissons.
On retrouve moins de bifidobactéries dans l’intestin de nouveau-nés nourris au lait maternisé mais une plus grande diversité microbienne. L’utilisation de prébiotiques dans le lait maternisé augmente la fraction bifidobactérienne dans l’intestin des nourrissons. Actuellement, les prébiotiques disponibles (les galacto- (GOS) et les fructo-oligosacharides (FOS)) sont métabolisés par les bifidobactéries, mais pas par l’hôte humain [5].
-
Puccio [6] a supplémenté du lait maternisé avec du 2’-O-fucosyllactose et du lacto-N-néotétraose, qui sont généralement contenus dans le lait maternel, et a obtenu de bons résultats. Le lait maternisé supplémenté en GOS, FOS et en Bifidobacterium breve compense le retard de colonisation par Bifidobacterium chez les nourrissons nés par césarienne, module le microbiote intestinal et reproduit les conditions observées chez les nourrissons nés par voie basse [6].
-
La comparaison de deux laits maternisés différents supplémentés en prébiotiques seuls ou en prébiotiques et probiotiques a montré des profils du microbiote intestinal similaires à ceux de nourrissons allaités (Tims & Phavichir [4]).
Prévention et traitement des allergies au lait de vache (alv)
-
Les probiotiques sont recommandés pour prévenir les ALV, mais davantage de données seraient bienvenues. Lactobacillus rhamnosus ou Bifidobacterium lactis ont été administrés à des mères tous les jours entre la 35e semaine de grossesse et 6 mois après l’accouchement et à des nourrissons de la naissance à l’âge de 2 ans. Les enfants ayant reçu Lactobacillus rhamnosus ont présenté une réduction significative de la prévalence de l’eczéma dans l’enfance (Wickens [4]).
-
Des laits infantiles fortement hydrolysés ont été supplémentés en L. rhamnosus our traiter les ALV à médiation de type IgE et favoriser le développement de la tolérance immunitaire. Les études cliniques menées chez des nourrissons en bonne santé et des nourrissons présentant une ALV ont montré que les laits infantiles à base d’acides aminés (LMAA) supplémentés en symbiotiques sont hypoallergéniques, bien tolérés, et garantissent une croissance normale.
-
Les résultats d’un essai multicentrique, en double aveugle, randomisé et contrôlé mené chez des nourrissons présentant des ALV à médiation de type non IgE ont été présentés (Candy [7]). Les nourrissons ont reçu du LMAA hypoallergénique contenant un mélange prébiotique d’oligofructose neutre dérivé de la chicorée et de Bifidobacterium breve à chaîne longue. À la 8e semaine, des différences importantes au niveau de la composition du microbiote intestinal étaient présentes entre les groupes, les pourcentages de bifidobactéries étant plus élevés dans le groupe ayant reçu du LMAA supplémenté en symbiotiques. La modulation du microbiote intestinal en utilisant ces symbiotiques spécifiques pourrait améliorer les symptômes chez les nourrissons présentant une ALV.
Coliques infantiles
Des données suggèrent qu’une altération du microbiote intestinal affecte la motilité intestinale et induit une production de gaz chez les nourrissons, ce qui entraîne des douleurs abdominales/coliques. La modulation du microbiote intestinal pourrait jouer un rôle dans la gestion et la prévention des coliques infantiles.
-
Une revue systématique Cochrane [4] des probiotiques prophylactiques dans les coliques infantiles a inclus des études portant sur Lactobacillus reuteri, des probiotiques issus de plusieurs souches Lactobacillus rhamnosus, Lactobacillus paracasei et Bifidobacterium animalis. Cette méta-analyse n’a montré aucune différence liée à l’utilisation de plusieurs probiotiques. Cependant, une analyse plus large a suggéré que les probiotiques étaient efficaces pour traiter les coliques infantiles (Ong [4]).