Allergies alimentaires
Phénomène en constante progression, les allergies alimentaires restent difficiles à prendre en charge. Mais de nouvelles thérapies voient le jour avec la découverte de l'implication du microbiote.
Le microbiote intestinal
Phénomène en constante progression, les allergies alimentaires restent difficiles à prendre en charge. Mais de nouvelles thérapies voient le jour avec la découverte de l'implication du microbiote.
Le microbiote intestinal
Fortement impliqué dans le développement de certaines maladies du foie, le microbiote intestinal pourrait devenir une cible thérapeutique majeure.
Le microbiote intestinal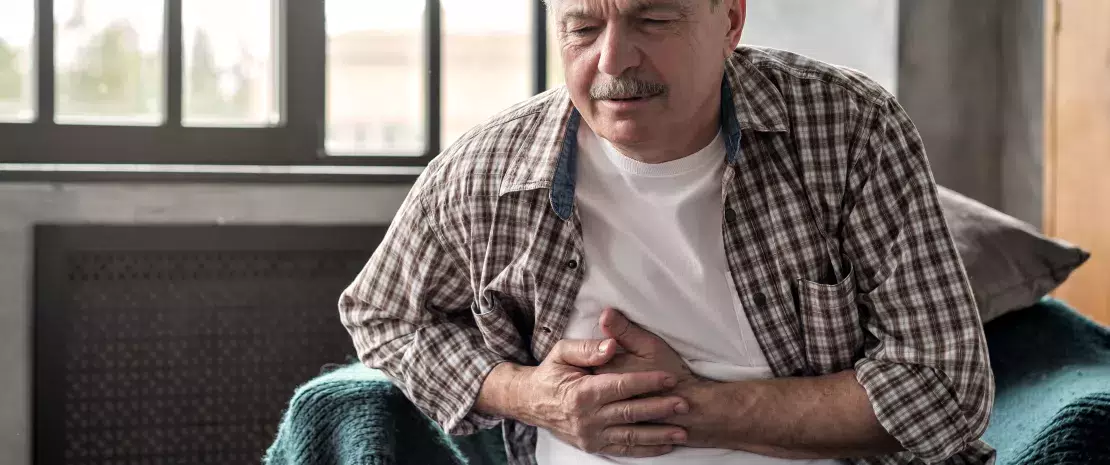
Le syndrome métabolique regroupe un ensemble de troubles métaboliques associés à l'obésité, tels l’hypertriglycéridémie ou l'hypertension artérielle, qui multiplient le risque de diabète et de complications cardiovasculaires.
Le microbiote intestinal
Votre série revient avec un 2ème épisode consacré au microbiote intestinal, allié indispensable de notre santé. Explorez avec Louise et Julie ce monde fascinant !
Le microbiote intestinal L'alimentation
 Montre-moi ta flore intestinale, et je te dirai d’où tu viens
Montre-moi ta flore intestinale, et je te dirai d’où tu viens
Avec leurs propriétés antagonistes, les bactériophages ont le potentiel de moduler le microbiote intestinal. Une étude a montré que le transfert de communauté virale modifiait le phénotype des souris receveuses obèses en un phénotype proche des souris donneuses minces.
Le microbiote intestinal Microbiote intestinal et métabolites circulants : quelles relations ? Transplantation de microbiote et diabète de type 1 : un essai chez l’homme Moins de dysbioses intestinales sous statines ?
Certaines bactéries typiques des produits laitiers, appelées lactobacilles, peuvent également vivre dans notre nez. Et des espèces spécifiques, particulièrement poilues, pourraient réduire le risque de sinusite.
Le microbiote ORL
Sources :
De Boeck I, van de Broek MFL, Allonsius CN, et al. Lactobacilli Have a Niche in the Human Nose. Cell Rep. 2020, 31(8):107674
Des chercheurs ont identifié une « signature » bactérienne du déclin cognitif et découvert comment un régime méditerranéen et cétogène (riche en graisses, pauvre en sucres) peut ralentir l’évolution de la maladie d’Alzheimer.
Le microbiote intestinal Maladie d'Alzheimer L'alimentation
 Alzheimer : comment notre intestin nous fait perdre la tête
Alzheimer : comment notre intestin nous fait perdre la tête
 Le microbiote intestinal, nouveau secret de jouvence ?
Le microbiote intestinal, nouveau secret de jouvence ?
Sources :
Nagpal R, Neth BJ, Craft S et al. Modified Mediterranean-ketogenic diet modulates gut microbiome and short-chain fatty acids in association with Alzheimer's disease markers in subjects with mild cognitive impairment. EBioMedicine. Vol: 47.p.529-542. 2019; https://doi.org/10.1016/j.ebiom.2019.08.032
Des bactéries intestinales et des métabolites sanguins signeraient la progression de la maladie rénale chronique. Au-delà de la possibilité de disposer demain de biomarqueurs, ces travaux avancent des pistes étiologiques.
Le microbiote intestinal Insuffisance rénale : l’impact du microbiote intestinal Lésions médullaires et troubles colorectaux : l'impact du microbiote intestinal Greffe rénale : la dysbiose préopératoire, facteur de diabète ?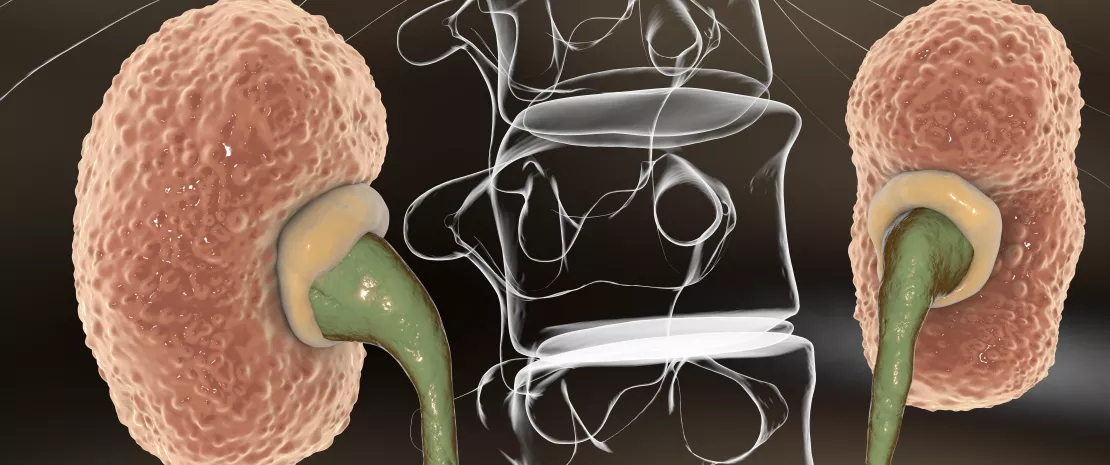
Une récente étude révèle enfin le mécanisme d’action bénéfique de certaines bactéries intestinales sur le taux de cholestérol chez l’homme, proposant ainsi un nouveau rôle précieux du microbiote intestinal sur la santé.
Le microbiote intestinal Le syndrome métabolique L'alimentation
Sources :
Kenny DJ, Plichta DR, Shungin D, et al. Cholesterol Metabolism by Uncultured Human Gut Bacteria Influences Host Cholesterol Level. Cell Host Microbe. 2020;S1931-3128(20)30295-X.
La dysbiose intestinale liée au stress serait impliquée dans la pathogenèse des troubles dépressifs. Elle limiterait l’efficacité d’une famille d’antidépresseurs via des altérations de la voie sérotoninergique.
Le microbiote intestinal Et si manipuler le microbiote améliorait la réponse à l’immunothérapie ? Exposition aux antibiotiques de 0 a 6 ans : un microbiote intestinal perturbe, un developpement de l’enfant altere Antibiotiques et risque de MICI: Qu’en est-il chez l’adulte ?