Dans la sphère urogénitale, ne surestime-t-on pas le pouvoir du microbiote ?
Depuis quelques années, le microbiote urogénital est mieux connu : on sait qu’il peut interférer avec des infections, des problèmes urinaires liés à la ménopause voire des tumeurs. Ce microbiote et ses anomalies doivent être pris en compte dans la prise en charge des patients, et les probiotiques faire partie de l’arsenal thérapeutique : ce n’est évidemment pas notre seule arme mais c’est un élément incontournable car les traitements anti-infectieux ne traitent pas la cause des récidives, à savoir la dysbiose.
Aujourd’hui, face aux infections urinaires, quelle peut être selon vous la place des probiotiques ?
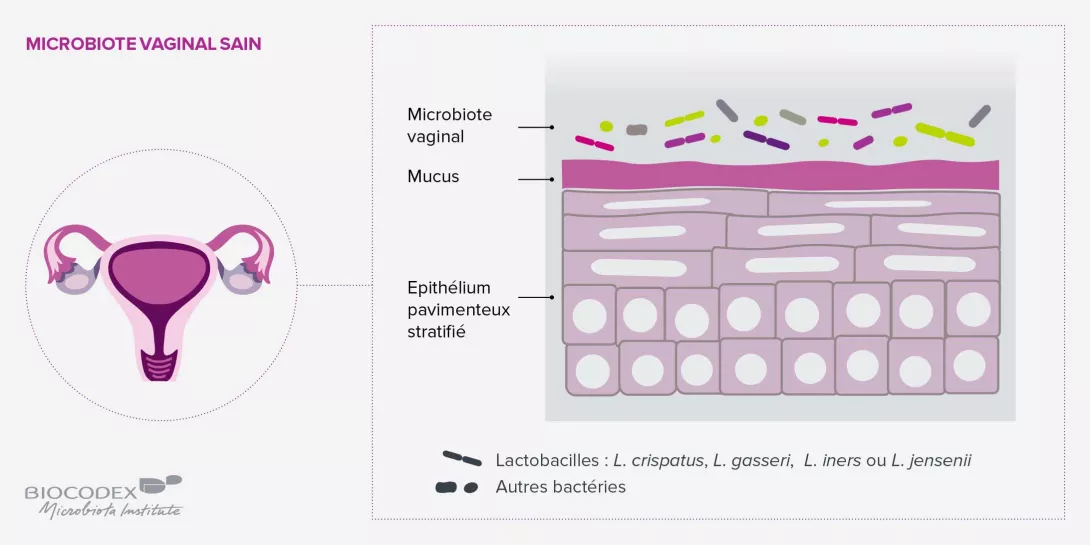
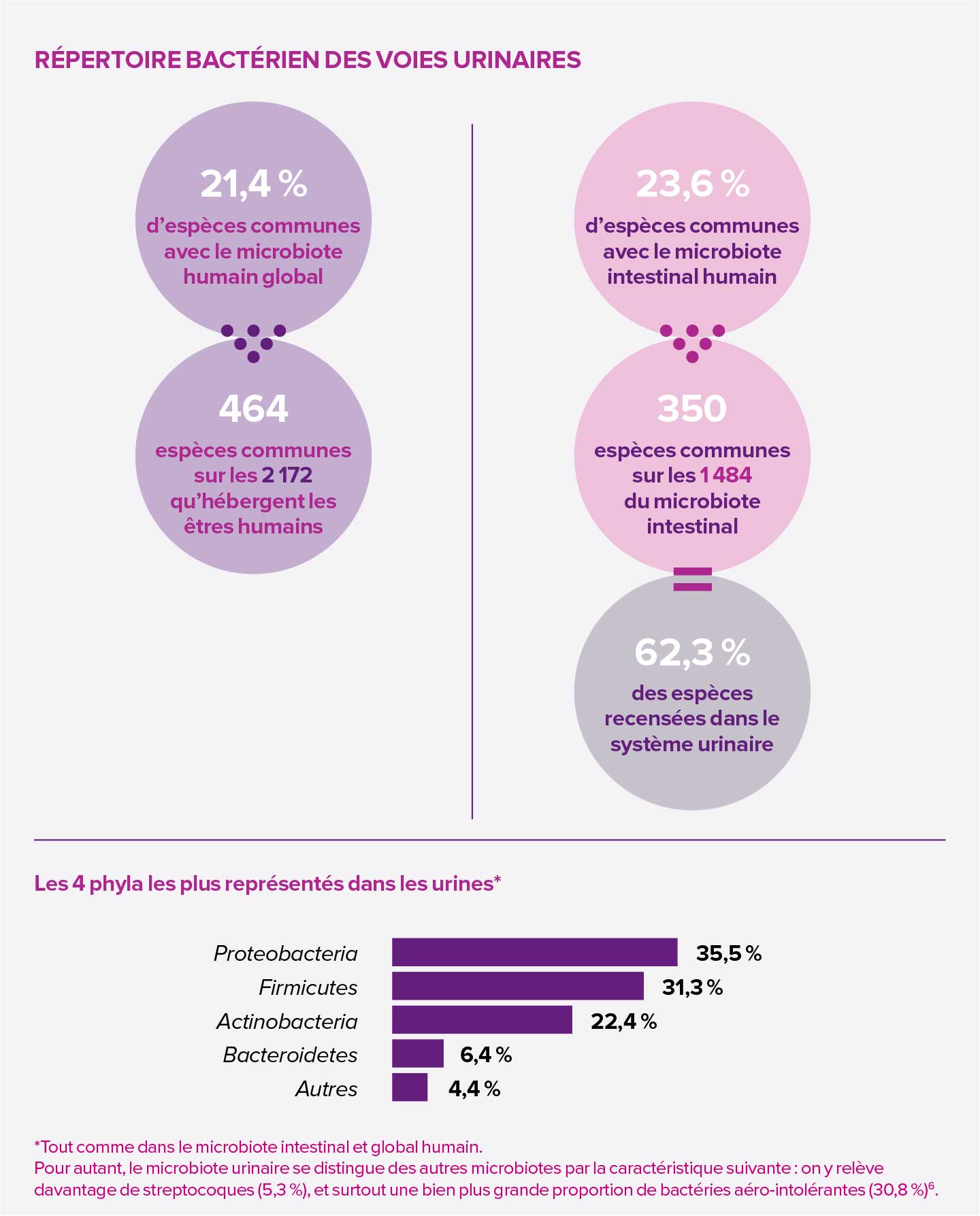
Les infections urinaires s’avèrent intimement liées au déséquilibre de 3 microbiotes : le microbiote urinaire, l’urine n’étant pas stérile ; le microbiote vaginal, avec lequel il partage de nombreuses similitudes ; et le microbiote intestinal, d’où proviennent les pathogènes impliqués dans les uropathologies, à l’instar d’E. coli qui transite de l’anus au vestibule vaginal puis à la vessie.
Face à une infection urinaire isolée, un traitement antibiotique classique se justifie. En revanche, en cas d’infection urinaire récidivante (plus de 4 épisodes par an), il est indispensable, après avoir éliminé des étiologies fonctionnelles (tumeur de la vessie, etc.), d’interroger la femme sur de possibles désordres du microbiote intestinal (constipation, etc.) et/ou du microbiote vaginal, qui joue un rôle de sas de protection entre les systèmes digestifs et urinaires. La prévention des récidives passera par la prescription, pendant 3 à 6 mois, de probiotiques intestinaux par voie orale en cas de dysbiose du microbiote intestinal et/ou de probiotiques vaginaux idéalement par voie vaginale. Ces traitements peuvent être associés à de la canneberge qui réduit la fixation des colibacilles dans la vessie.
Et dans les infections vaginales ?
Il existe deux types d’infections vaginales : les infections endogènes liées au développement de micro-organismes (bactéries ou champignons) endogènes ; et les infections exogènes contractées lors de rapports sexuels. Pour les infections endogènes, en cas d’épisode isolé, un ovule antimycosique ou un traitement antibiotique peut suffire. Mais s’il existe un risque de récidive, la dysbiose doit être traitée via la prescription de probiotiques gynécologiques durant plusieurs mois. Les probiotiques trouvent aussi leur place face aux infections exogènes : plus le microbiote vaginal est déséquilibré, plus le risque d’acquérir une IST (Infection sexuellement transmissible) s’accroît, de même que le risque d’une évolution défavorable. Par exemple, le papillomavirus a 4 à 5 fois plus de risque de ne pas être totalement éliminé en cas de dysbiose, et la lésion évolue plus rapidement vers des formes potentiellement cancéreuses. D’où l’importance d’évaluer un possible déséquilibre du microbiote vaginal chez les femmes infectées par simple mesure de l’acidité (le pH doit être compris entre 3,5 et 4,5) puis par prélèvement vaginal si le pH est supérieur à 4,5. En cas de déséquilibre, des probiotiques testés en laboratoire et ayant fait l’objet d’études cliniques doivent être prescrits. Une dysbiose vaginale augmente également le risque de contracter le VIH : alors que l’acidité des lactobacilles détruit le virus, un état inflammatoire multiplie la présence de lymphocytes qui sont au- tant de cellules cibles du virus.
Enfin, que peut-on attendre de la transplantation de microbiote vaginal ?
Un peu plus d’une vingtaine de cas de transplantation vaginale ont été publiés. Si les résultats sont intéressants, ils ne sont pas encore décisifs. L’idée de transplanter un microbiote pour régler une vaginose bactérienne récidivante se heurte encore à la définition des critères de choix pour la donneuse - d’autant que l’absence de symptômes ne signifie pas que sa flore est équilibrée, et d’indications pour la receveuse. D’ici un an ou deux, on saura sans doute si la transplantation vaginale peut être utilisée en dernier recours.

 Montre-moi ta flore intestinale, et je te dirai d’où tu viens
Montre-moi ta flore intestinale, et je te dirai d’où tu viens
 MICROREVEAL #2 : zoom sur le microbiote intestinal
MICROREVEAL #2 : zoom sur le microbiote intestinal