ЧТО МЫ УЖЕ ЗНАЕМ?
Нарушениями нейроразвития страдает до 8,4% детей в возрасте младше 5 лет во всем мире. Рост окружности головы (РОГ) представляет собой показатель, коррелирующий с ранним нейроразвитием.
Важно установить факторы окружающей среды, на которые можно воздействовать, чтобы уменьшить частоту нарушений нейроразвития. Исследования в области интервенционного питания не дали существенных результатов. Авторы изучили микробиом кишечника (МК), поскольку его формирование в первые месяцы и применение антибиотиков на первом году жизни связаны с различными заболеваниями, включая нарушения нейроразвития в более позднем детстве, среди которых особо следует отметить синдром дефицита внимания с гиперактивностью и расстройства аутистического спектра. Цель исследования — определить существование взаимосвязи между характеристиками раннего МК и задержкой роста окружности головы (ЗРОГ).
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
В период с января 2010 года по декабрь 2018 года в исследование включали детей в возрасте до 37 недель из отделения новорожденных в Чикаго. Динамику РОГ рассчитывали как разницу между значениями окружности головы при рождении и через 36 недель. Для определения групп, имеющих нормальный РОГ (НРОГ) и его отклонения (легкая, умеренная и тяжелая задержка), использовали пороговые интервалы в 0,5 см.
В возрасте 30 недель у детей с НРОГ и ЗРОГ отмечались значимые различия в β-разнообразии и соотношении бактериальных таксонов кишечной микробиоты. Между 31 и 36 неделями отставание в РОГ в группе ЗРОГ составило > 0,5 см. Это показывает, что задержке роста окружности головы предшествует незрелость КМ.
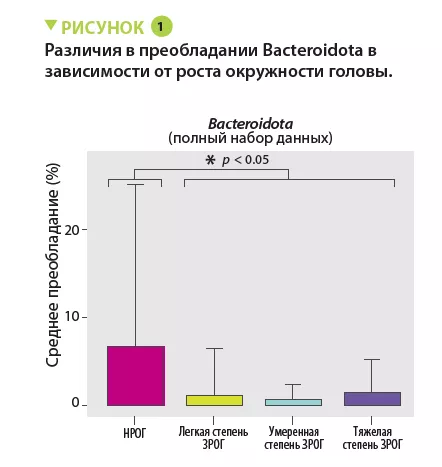
В период между 31 и 36 неделями у детей с ЗРОГ наблюдалось значимое уменьшение преобладания Bacteroidota (p = 0,0009) (рисунок 1) и Lachnospiraceae (p = 0,009), что могло привести к снижению утилизации углеводов этими таксонами. Распространенность семейства Ruminococcaceae (р = 0,007) происходила за счет вида Faecalibacterium prausnitzii (р = 0,004) у 48% детей в группе НРОГ и 8% в группе ЗРОГ. Следует отметить увеличение содержания Firmicutes в группах ЗРОГ с 24 по 30 неделю (p = 0,009), но без каких-либо различий по представителям.
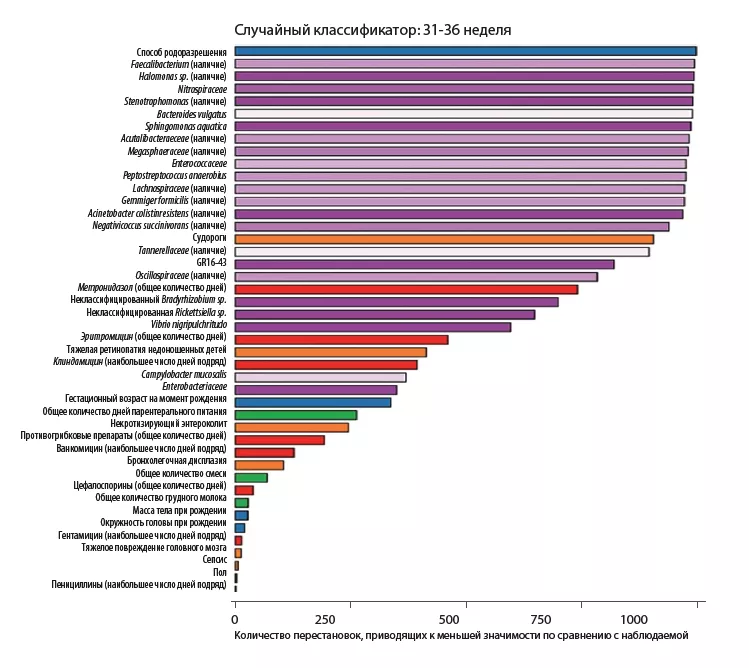
Результаты анализа клинических параметров показали, что изменения РОГ не были связаны с количеством потребляемых калорий. Частота таких состояний, как некротизирующий энтероколит (р = 0,0006), тяжелое повреждение нервной системы (р = 0,01) и сепсис (р = 0,03), была выше в группе ЗРОГ по сравнению с группой НРОГ. Тем не менее, используемые аналитические методы, такие как модель со случайным принятием решений и перестановками, показали, что в периоды с 24 по 30 неделю и с 31 по 36 неделю наиболее важными факторами, связанными с динамикой РОГ, б ы л и характеристики КМ, а не сопутствующие заболевания (рисунок 2). У детей без тяжелых заболеваний все еще наблюдались различия по содержанию Bacteroidota и Lachnospiraceae, однако преобладание Actinobacteriota было значимо выше в группах НРОГ и ЗРОГ легкой степени, чем в группах ЗРОГ средней и тяжелой степени.
с передачей КМ при родах, поскольку у детей, рожденных естественным путем, преобладание Bacteroidota было выше, чем у детей, появившихся на свет путем кесарева сечения. Кроме того, среди родившихся естестве ным путем , удетей с З Р О Г отмечалось меньшее количество описанных выше таксонов в сравнении с детьми с НРОГ. Сроки родов также являются важным фактором, поскольку все дети с ЗРОГ, рожденные естественным путем, родились в срок < 27 недель, тогда как лишь 17% детей с НРОГ, рожденных естественным путем, родились в срок < 27 недель.
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Из всего вышесказанного можно сделать вывод, что развитию ЗРОГ предшествует снижение численности Bacteroidota и Lachnospiraceae, а затем — Actinobacteriota.
Естественные роды обеспечивают вертикальную передачу Bacteroidota.
Однако следует проявлять бдительность в отношении детей, родившихся до 27 недели: они имеют более высокий риск ЗРОГ вне зависимости от способа родоразрешения.
Исследования по оценке оптимизации КМ с первых дней жизни у недоношенных детей смогут подтвердить и уточнить эти результаты.