МИКРОБИОТА КИШЕЧНИКА #15
Проф. Маркку Вотилайнен (Markku Voutilainen)
Медицинский факультет Университета Турку; Университетская больница Турку, отделение гастроэнтерологии, Турку, Финляндия
МИКРОБИОТА КИШЕЧНИКА МОДУЛИРУЕТ ОТВЕТ НА ЛЕЧЕНИЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
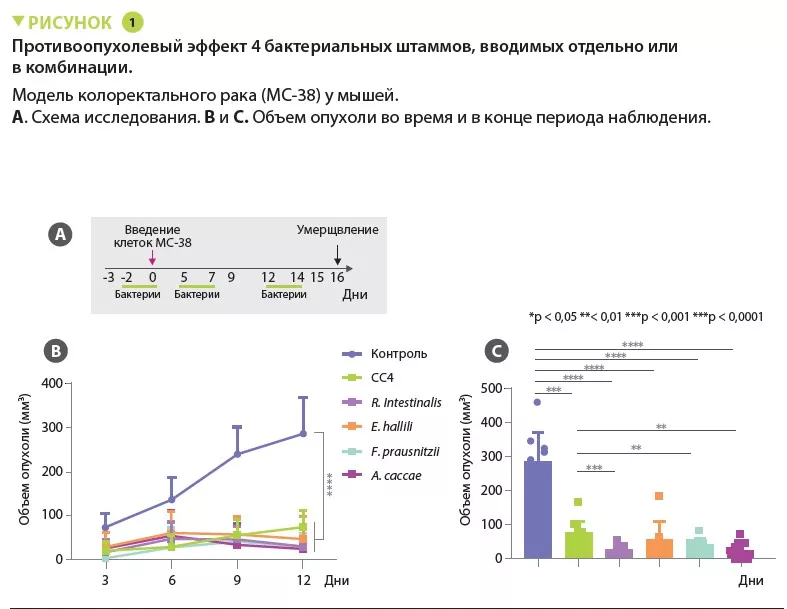
Рак предстательной железы (РПЖ) является одним из наиболее распространенных онкологических заболеваний у мужчин. Поскольку рост и прогрессирование опухоли зависит от уровня андрогенов, для лечения пациентов с РПЖ прибегают к андрогенной депривационной терапии (АДТ), хирургической или химической кастрации. Тем не менее, у некоторых пациентов развивается кастрационно-резистентный рак предстательной железы (КРРПЖ), который рано или поздно начинает прогрессировать. В настоящее время усилия онкологов направлены на изучение и поиск новых методов лечения КРРПЖ. Так как недавние исследования показали влияние микробиоты на развитие онкологических заболеваний и эффективность терапии, авторы использовали мышиную модель РПЖ и данные пациентов для изучения роли кишечной микробиоты в развитии РПЖ. Развитие КРРПЖ у мышей ассоциировалось с увеличением содержания Ruminococcus spp. и Bacteroides acidifaciens, тогда как абляция кишечной микробиоты замедляла рост опухоли. ТФМ от мышей с КРРПЖ и введение R. gnavus приводило к повышению уровней циркулирующих андрогенов, ускорению роста РПЖ и развитию КРРПЖ. Рост РПЖ удавалось замедлить с помощью ТФМ от пациентов с гормонально-чувствительными опухолями и путем введения Prevotella stercorea. У пациентов с КРРПЖ наблюдалось увеличение содержания родов Ruminococcus и Bacteroides в кишечнике, что ассоциировалось с плохими исходами, в то время как у пациентов с гормонально-чувствительным РПЖ наблюдалось более высокое содержание представителей рода Prevotella, связанное с лучшими исходами.
Комменсальная микробиота кишечника у пациентов и мышей с дефицитом андрогенов способна продуцировать эти гормоны, которые, попадая в кровоток, стимулируют рост РПЖ и развитие КРРПЖ. Модуляцию кишечной микробиоты теоретически можно использовать в качестве дополнительной терапии РПЖ.
СВЯЗЬ МЕЖДУ ДИСБИОЗОМ КИШЕЧНИКА И ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЕГКИХ
Хроническая обструктивная болезнь легких (ХОБЛ) охватывает ряд заболеваний легких (эмфизема, бронхит и астма) и в конечном итоге приводит к прогрессирующему респираторному дистрессу. Недавние исследования выявили изменения микробиоты кишечника, ассоциированные с развитием заболеваний легких. Хотя ХОБЛ в первую очередь считается респираторным заболеванием, она обычно сочетается с хроническими заболеваниями желудочно-кишечного тракта. В настоящем исследовании авторы изучали ось «кишечник – легкие» в контексте ХОБЛ. Результаты анализа кала показали, что пациенты с тяжелой ХОБЛ имели меньше Bacteroidetes и больше — Firmicutes. Численность представителей семейства Prevotellaceae была выше при ХОБЛ легкой степени тяжести, а Bacteroidaceae и Fusobacteriaceae — при ХОБЛ тяжелой степени по сравнению с контрольной группой (здоровые). Уровни короткоцепочечных жирных кислот (КЦЖК) были значимо ниже при тяжелой ХОБЛ. ТФМ от пациентов с ХОБЛ вызывала значимое снижение массы тела и гиперсекрецию слизи в дыхательных путях у мышей. После ТФМ у мышей отмечалось ускорение снижения функции легких при хроническом воздействии дыма.
Исследование показало, что у пациентов с ХОБЛ наблюдается дисбиоз кишечной микробиоты со сниженными уровнями КЦЖК. Эти изменения могут быть связаны с в о с п а л е н и е м д ы х а т е л ь н ы х п у т е й и прогрессированием ХОБЛ.
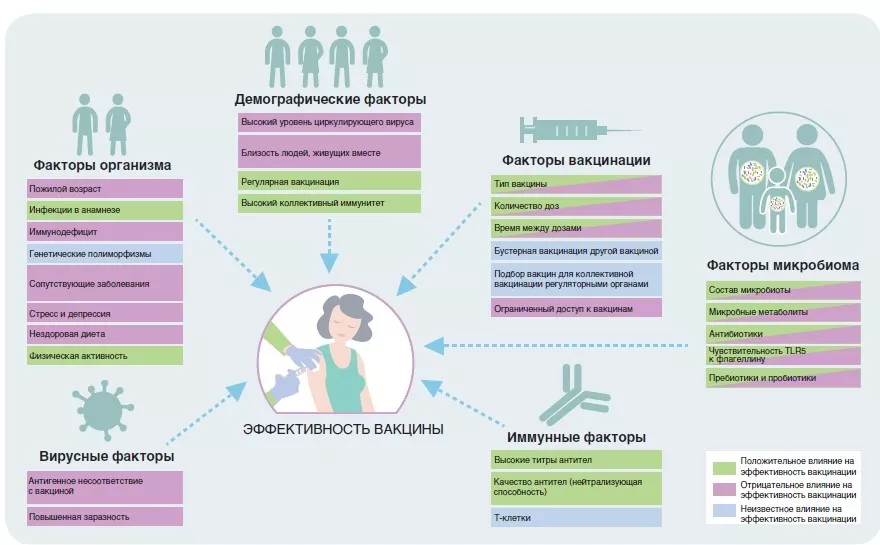
ВЛИЯНИЕ СОПУТСТВУЮЩЕЙ ЛЕКАРСТВЕННОЙ ТЕРАПИИ НА ЭФФЕКТИВНОСТЬ ИНГИБИТОРОВ КОНТРОЛЬНЫХ ТОЧЕК ИММУННОГО ОТВЕТА
Ингибиторы контрольных точек иммунного ответа (ИКТ) совершили прорыв в лечении ряда злокачественных новообразований. Д а н н ы е п о к а з ы в а ю т , ч т о м и к р о б и о т а кишечника способна модулировать ответ на терапию ИКТ и может быть вовлечена в п а т о г е н е з и м м у н о о п о с р е д о в а н н ы х нежелательных явлений (иоНЯ).
Хотя доказано, что антибиотики ухудшают прогноз у онкологических пациентов, получавших ИКТ, о влиянии на микробиоту различных сопутствующих лекарственных препаратов, применяемых в начале лечения ИКТ, известно достаточно мало. В настоящем исследовании авторы изучили влияние сопутствующих лекарственных препаратов, назначенных за 1 месяц до или после начала терапии ИКТ, на результаты лечения и возникновение иоНЯ.
Применение антибиотиков, глюкокортикоидов (суточная доза > 10 мг), ингибиторов протонной помпы, психотропных препаратов, морфина и инсулина было связано со значимым уменьшением выживаемости и вероятности ответа со стороны опухоли. Сочетанное применение этих препаратов снижало выживаемость в большей степени, чем монотерапия ИКТ. Эти препараты также были связаны с уменьшением частоты возникновения иоНЯ. Одновременное применение статинов, ингибиторов ангиотензинпревращающего фермента и/или блокаторов рецептора ангиотензина II, нестероидных противовоспалительных препаратов, аспирина и пероральных противодиабетических препаратов не влияло на выживаемость пациентов.
Результаты исследования показали, что сопутствующая медикаментозная терапия влияет на эффективность ИКТ и возникновение иоНЯ. Это влияние может быть опосредовано через микробиоту или другие иммуномодулирующие механизмы. В клинической практике при планировании терапии ИКТ следует тщательно оценивать сопутствующие лекарственные препараты. По возможности следует избегать применения препаратов, негативно влияющих на ИКТ.