Связь между микробиотой полости рта и инфекцией sars-cov-2
Обзорная статья
Д-р Джей Пател (Jay Patel)
Ашерский институт медико-санитарных наук и информатики, Эдинбургский университет, Соединенное Королевство

В полости рта содержится множество разнообразных микроорганизмов, заключенных во внеклеточную матрицу. Недостаточная гигиена полости рта приводит к дисбиотическим изменениям полимикробной биопленки, стимулируя более патогенные виды бактерий к колонизации и размножению. Хотя известно, что микробиота опосредует воспаление, недавние исследования показывают, что дисбиоз микробиоты полости рта может быть связан с тяжестью и продолжительностью симптомов Covid-19. В такой ситуации правильная гигиена полости рта может улучшить клинические результаты.
ИСТОРИЯ СОПУТСТВУЮЩИХ ИНФЕКЦИЙ
Известно, что вирусные инфекции могут вызывать бактериальные коинфекции. Большинство смертей во время пандемии гриппа 1918 года были напрямую связаны со вторичной бактериальной пневмонией [1]. Тяжелые клинические исходы во время пандемии гриппа H1N1 в 2009 году также были связаны с бактериальными коинфекциями [2]. Проблема смешанной вирусно-бактериальной инфекции при вспышках инфекционных заболеваний может значительно осложнить выработку стратегий лечения, замедлить сроки выздоровления и ускорить возникновение резистентности к противомикробным препаратам. К счастью, результаты многоцентрового когортного исследования, в котором приняли участие около 50 000 пациентов, показали, что у людей, госпитализированных с Covid-19, было зарегистрировано мало бактериальных инфекций [3]. Однако следует отметить, что диагностика сочетанных инфекций относительно сложна, поскольку бактериальная инфекция может присутствовать до развития вирусной инфекции в качестве сопутствующего хронического заболевания или может быть вызвана внутрибольничным заражением [4].
МИКРОБИОТА ПОЛОСТИ РТА: ОТ ЭУБИОЗА К ДИСБИОЗУ
Ротовая полость и верхние дыхательные пути содержат большое количество разнообразных бактерий. У здорового человека микробиом полости рта находится в тонком равновесии, однако небольшие изменения повседневных привычек могут привести к существенным сдвигам в этом симбиозе. Недостаточная гигиена полости рта может способствовать переходу микробиома в патологическое состояние дисбиоза, при котором вероятность развития болезненных процессов резко возрастает [5, 6].
Заболевания периодонта, такие как хроническое воспаление десен (гингивит), в первую очередь опосредованы воспалительными процессами в биопленке, что изменяет архитектуру тканей вплоть до образования мелких язвенных дефектов. Формируется патологическая связь между полостью рта и кровью, когда рутинные действия, например, жевание, использование зубной нити и чистка зубов, вызывают бактериемию. Бактерии и медиаторы воспаления из полости рта распространяются с током крови, достигая жизненно важных органов. Имеющиеся данные показывают, что бактериемия может вызывать значительные нарушения, способствуя развитию слабого системного воспаления, на фоне которого могут возникать более тяжелые воспалительные заболевания [5]. Более того, известно, что периодонтит способствует возникновению сахарного диабета II типа, а дисбиоз микробиоты полости рта вовлечен в патогенез нарушений пародонта и метаболических заболеваний (сердечно-сосудистые заболевания, дислипидемия и т. д.) [7].
ЕСТЬ ЛИ СВЯЗЬ МЕЖДУ ДИСБИОЗОМ ПОЛОСТИ РТА И ТЯЖЕСТЬЮ COVID-19?
В этой области проведено не так много исследований, но все они указывают на существование связи между дисбиозом полости рта и тяжестью Covid-19. В двойном слепом поперечном исследовании, проведенном в Египте с участием 303 пациентов с подтвержденным ПЦР диагнозом Covid-19, изучали взаимодействия между тремя факторами: 1) гигиеной полости рта, 2) тяжестью Covid-19 и 3) уровнем С-реактивного белка (СРБ) . СРБ является маркером гипервоспаления, поэтому у пациентов с высоким уровнем СРБ можно ожидать худший прогноз COVID-19 [8]. Исследователи обнаружили, что плохое состояние полости рта коррелировало с повышенными значениями СРБ и замедленным выздоровлением.
В несравнительном исследовании случай-контроль, проведенном в Катаре с участием 568 пациентов, была показана связь между наличием периодонтита и тяжелыми осложнениями COVID-19, включая увеличение в 3,5 раза потребности в ИВЛ, увеличение в 4,5 раза риска попадания в реанимацию и увеличение в 8,8 раза риска смерти [9]. Однако эти результаты не указывают на причинно-следственную связь из-за возможного существования других вмешивающихся факторов, поэтому необходимы дальнейшие исследования относительно истинного влияния дисбиоза полости рта на исходы Covid-19.
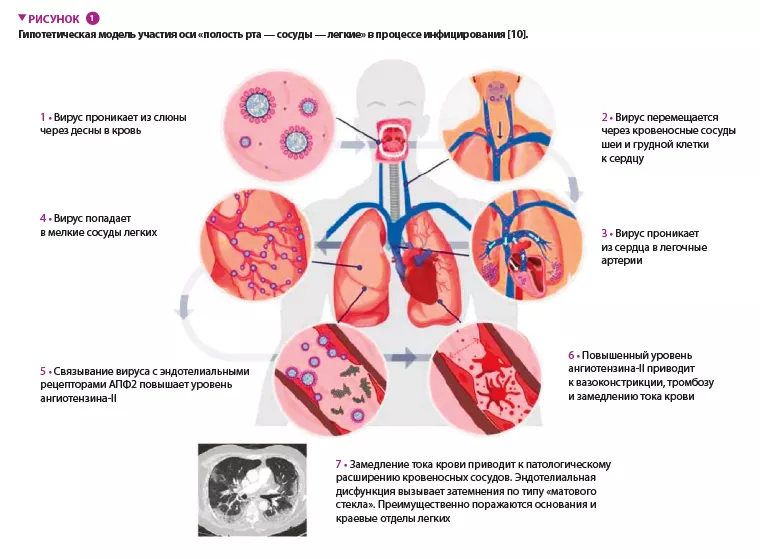
Эта в значительной степени гипотетическая связь основана на ряде факторов, которые имеют общую значимость в патофизиологии инфекции SARS-CoV-2 и периодонтита. Во-первых, легочные рентгенологические признаки первично сосудистого повреждения предполагают существование оси «полость рта — сосуды — легкие», образующей прямой путь распространения инфекции в дополнение к непосредственной доставке патогенов в легочные сосуды с током крови (рисунок 1) [10]. Во-вторых, данные метагеномного анализа показали, что верхние дыхательные пути, главный анатомический о ч а г п е р в и ч н о й и н ф е к ц и и , с о д е р ж а т многие виды бактерий, вовлеченные в развитие заболеваний полости рта, которая может служить естественным вирусным резервуаром. В-третьих, выживание вирусов в десневой биопленке и их способность к транслокации из слюны в зубодесневой карман способствуют избеганию иммунного ответа. В - ч е т в е р т ы х , э т о о б и л и е р е ц е п т о р о в ангиотензинпревращающего фермента 2 на ключевых компонентах оси «полость рта — сосуды — легкие».
ПРАВИЛЬНАЯ ГИГИЕНА ПОЛОСТИ РТА
Независимо от точного состава микроорганизмов, вовлеченных в патофизиологию Covid-19, необходимо соблюдать правильную гигиену полости рта для поддержания стоматологического и общего здоровья. Тщательная чистка зубов два раза в день , обработка межзубных промежутков и полоскание рта с использованием специальных средств — все это относительно простые меры, позволяющие удалить биопленку, поддерживать симбиотическую флору и уменьшить концентрацию вирусов в слюне.
Заключение
Влияние гигиены полости рта на тяжесть исходов Covid-19 пока недостаточно изучено. Однако можно предположить существование клинически значимого взаимодействия. Правильная гигиена полости рта имеет очевидные преимущества для здоровья, а при инфекции SARS-CoV-2 также может улучшать прогноз заболевания.