Helicobacter pylori e microbiota gastrointestinal
Pelo Prof. Juozas Kupcinskas
Departamento de Gastroenterologia e Instituto de Investigação Digestiva, Universidade Lituana de Ciências da Saúde, Kaunas, Lituânia
A Helicobacter pylori (H. pylori) afeta cerca de 50% da população mundial e é a infeção bacteriana mais comum em todo o mundo. De acordo com a Organização Mundial de Saúde (OMS), a H. pylori está classificada como um agente cancerígeno do Grupo 1, que pode causar doenças précancerosas e cancerosas no estômago, incluindo o adenocarcinoma gástrico. Anteriormente, acreditava-se que a H. pylori era o único microrganismo que vivia no estômago humano, mas os recentes avanços nas tecnologias de investigação permitiram uma melhor compreensão do microbioma gástrico. A H. pylori desempenha um papel fundamental na formação do ambiente microbiano do estômago. No entanto, o microbioma “não-Helicobacter” do estômago também foi descrito e é um tema quente na investigação atual. É evidente que a H. pylori é um dos principais modificadores do microbioma gástrico, mas outras espécies podem também contribuir para as vias carcinogénicas. Os efeitos dos inibidores da bomba de protões (IBP) e das terapias de erradicação da H. pylori nas alterações do microbioma também têm sido estudados. Neste artigo de revisão, pretendemos resumir as descobertas recentes sobre o microbioma gástrico e o papel da H. pylori na sua formação, bem como o impacto da erradicação da H. pylori e dos IBP no microbioma humano
A H. pylori é a principal bactéria que molda a composição do microbioma gástrico
O microbioma gástrico está a receber cada vez mais atenção, com um interesse crescente nos seus fatores determinantes. Vilchez-Vargas et al. investigaram a composição microbiana em vários compartimentos gastrointestinais (GI). O seu estudo envolveu uma coorte de 108 pares de gémeos, tendo sido analisadas biópsias do microbioma gástrico da mucosa do estômago. A diversidade do microbioma foi avaliada utilizando as regiões V1-V2 do gene 16S rRNA através de amplificação e sequenciação. Os resultados alinham-se com achados anteriores, destacando o H. pylori como um fator chave na composição da microbiota do estômago 1.
Hua et al. realizaram um estudo com uma coorte de 193 pacientes para examinar o impacto da H. pylori na riqueza e diversidade do microbiota gástrico em indivíduos com gastrite crónica. Traçaram o perfil da região V3-V4 do gene 16S rRNA e encontraram alterações significativas no microbiota gástrico devido à infeção por H. pylori. Especificamente, a H. pylori suprimiu a microbiota gástrica dominante ao nível do género, incluindo Aliidiomarina, Reyranella, Halomonas, Pseudomonas e Acidovorax. As suas descobertas indicaram que estirpes virulentas de H. pylori estavam significativamente associadas à gastrite atrófica crónica e à diminuição da riqueza do microbiota gástrico 2.
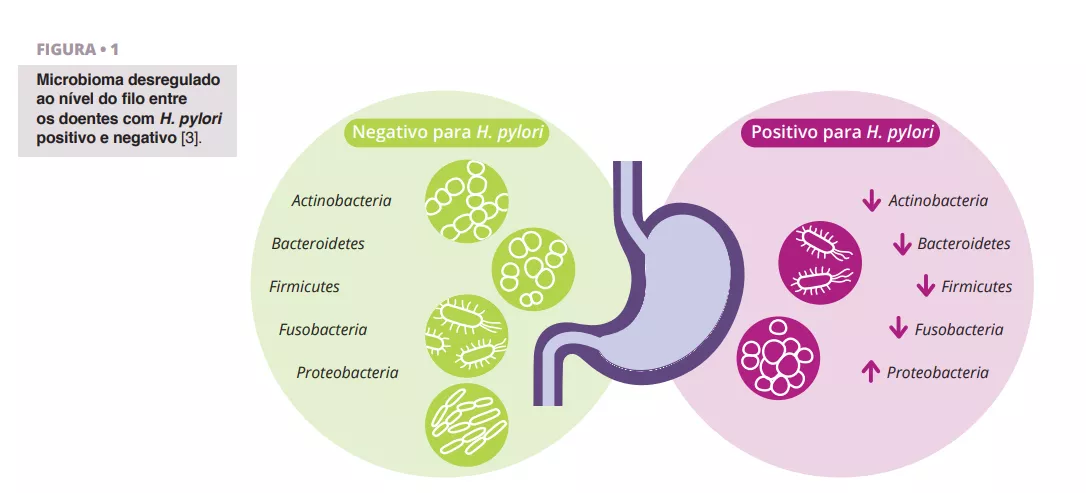
Schulz et al. analisaram as diferenças na composição da microbiota entre pacientes infetados por H. pylori e pacientes negativos para H. pylori. Observaram uma diferença significativa na abundância relativa de Proteobactérias, que eram mais prevalentes nos aspirados de pacientes infetados com H. pylori. Outros filos apresentaram uma abundância relativa mais baixa (figura 1) 3
Miftahussurur et al. investigaram a variabilidade do microbiota gástrico entre pacientes H. pylori positivos e H. pylori negativos numa coorte de 137 indivíduos da população indonésia. Verificaram que a β-diversidade e a riqueza microbianas eram significativamente mais elevadas nas amostras positivas para H. pylori em comparação com as amostras negativas para H. pylori. Além disso, os seus resultados sugeriram que o H. pylori desempenha um papel principal na formação da comunidade microbiana gástrica neste grupo étnico 4.
Estes estudos destacam coletivamente a H. pylori como um fator crucial para influenciar a diversidade e a riqueza do microbioma gástrico no ambiente estomacal agressivo.
O que é umverdadeiro microbioma gástrico?
O estômago apresenta condições extremas para os microrganismos vivos. Há algumas décadas, a H. pylori foi identificada como uma bactéria capaz de resistir a estas condições estomacais adversas. Esta descoberta despertou a curiosidade e levou a mais investigação sobre o microbioma gástrico. Continua a ser incerto se as bactérias não-Helicobacter no estômago representam contaminantes transitórios ou parte de uma microbiota persistente. Spiegelhauer et al. efetuaram um estudo que envolveu 22 doentes com dispepsia e 12 com adenocarcinoma gástrico 5. Foram realizadas biópsias da mucosa gástrica e analisada a região V3- V4 do gene 16S rRNA, além da cultura de microrganismos. Os autores levantaram a hipótese de que a H. pylori é a única bactéria verdadeiramente residente no estômago e que persistiria em biópsias lavadas. Os seus resultados indicaram que a carga bacteriana diminuiu nas biópsias lavadas, sugerindo uma contaminação transitória a partir da cavidade oral. No entanto, a diversidade de microrganismos não diferiu entre as biópsias não lavadas e as lavadas.
Ainda não é claro se os microrganismos não-H. pylori no estômago são contaminantes transitórios ou verdadeiros residentes.
É possível que a saliva engolida continuamente, contendo organismos vivos, possa sobreviver às condições ácidas durante algum tempo. A contaminação da região orofaríngea superior durante a gastroscopia e a colheita de amostras também deve ser considerada 6. Estes resultados realçam a necessidade de mais investigação sobre o verdadeiro microbioma gástrico.
Efeito da erradicação da H. pylori no microbioma gástrico e intestinal
A H. pylori é uma das infeções mais disseminadas a nível mundial, afetando mais de metade da população humana. A maioria dos regimes de tratamento da H. pylori envolve dois ou mais antibióticos, o que pode afetar o microbioma gastrointestinal. Liou et al. investigaram alterações a longo prazo na microbiota intestinal após a erradicação da H. pylori. O seu estudo multicêntrico e aleatório incluiu 1620 participantes que foram distribuídos aleatoriamente por três grupos de tratamento. Os autores avaliaram a diversidade bacteriana em vários momentos após a erradicação através da análise de amostras fecais. Os resultados mostraram que tanto a diversidade alfa como a diversidade beta diminuíram nas duas semanas após a erradicação, mas voltaram aos níveis de base na oitava semana e um ano depois. Estes resultados indicam apenas uma perturbação a curto prazo do microbioma gastrointestinal e sugerem que a terapia de erradicação da H. pylori é geralmente segura a longo prazo 7.
He et al. relataram alterações no microbioma gastrointestinal após a erradicação da H. pylori, utilizando a análise do gene 16S rRNA de amostras da mucosa gástrica e fecais. Verificaram que a diversidade alfa do microbioma gástrico aumentou e que a diversidade beta do microbioma intestinal diferia significativamente dos níveis pré-tratamento, mas assemelhava-se à dos controlos saudáveis 24 semanas após a erradicação 8.
Guo et al. resumiram os resultados sobre as alterações no microbioma gástrico após um tratamento bem-sucedido da H. pylori. A sua revisão sistemática e meta-análise incluíram nove estudos com 546 pacientes. Esta meta-análise é a primeira a detalhar as alterações na diversidade alfa após a erradicação da H. pylori. Os resultados não indicaram diferenças significativas na diversidade da microbiota entre as opções de tratamento, quer fosse utilizada terapia quádrupla ou tripla. Os autores observaram um aumento da diversidade alfa a curto prazo, que persistiu no seguimento a longo prazo, com uma depleção de taxa relacionados com a H. pylori e enriquecimento de comensais gástricos comuns 9. Para avaliar o efeito da erradicação da H. pylori no microbioma intestinal, Yap et al. realizaram um estudo com 17 jovens adultos. Sequenciaram a região V3-V4 do gene 16S rRNA e analisaram o microbioma intestinal antes e 18 meses após a erradicação da H. pylori utilizando claritromicina e metronidazol. Não foram observadas alterações significativas na diversidade microbiana entre a linha de base e 18 meses após a erradicação 10.
Os IBP são importantes modificadores do microbioma intestinal
O consumo global de inibidores da bomba de protões (IBP) está a aumentar, tornando-os um dos 10 medicamentos mais utilizados no mundo 11. São um tratamento de primeira linha para doenças como a doença do refluxo gastroesofágico, a úlcera péptica, a dispepsia e, quando combinados com antibióticos, para o tratamento da H. pylori 12. Os IBP são frequentemente utilizados sem indicações baseadas em provas ou por períodos mais longos do que o prescrito, e a sua utilização tem sido associada a um risco acrescido de infeções como Clostridium difficile, Salmonella spp.
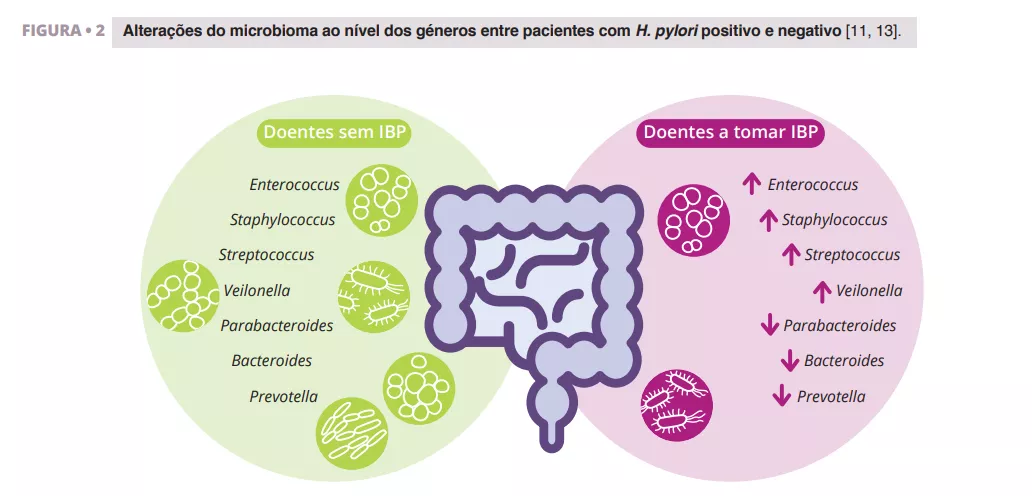
Imhann et al. analisaram o microbioma de 211 indivíduos que utilizavam IBP através da sequenciação da região V4 do gene 16S rRNA. Observaram uma diminuição significativa da diversidade alfa entre os utilizadores de IBP e um aumento da abundância de bactérias dos géneros Enterococcus, Streptococcus, Staphylococcus e Veillonella (figura 2). Os géneros Enterococcus e Veillonella têm sido associados a uma maior suscetibilidade a infeções por Clostridium difficile 11. . Embora os IBP sejam geralmente considerados seguros, com efeitos secundários relativamente raros, as provas sugerem que têm um impacto negativo no microbioma intestinal.
Zhang et al. efetuaram uma meta-análise dos efeitos dos IBP na microbiota intestinal humana, analisando dados de quatro estudos com sequenciação de amplicões do gene 16S rRNA. Os seus resultados demonstraram um impacto significativo da utilização de IBP na diversidade microbiana, com uma menor diversidade alfa observada nos utilizadores de IBP em comparação com os controlos. Encontraram reduções nos géneros Parabacteroides, Veillonella, Bacteroides e Prevotella, bem como nas famílias Ruminococcaceae e Lachnospiraceae (figura 2) 13.
Weitsman et al. realizaram um estudo com 177 indivíduos, combinando utilizadores de IBP 1:2 com controlos. Analisaram amostras de fezes e, pela primeira vez, microbiomas duodenais. Não foram encontradas diferenças significativas na diversidade alfa ou beta entre os utilizadores de IBP e os controlos. No entanto, ao nível das famílias, observaram uma maior abundância relativa de Campylobacteraceae (filo Proteobacteria) e uma menor abundância relativa de Clostridiaceae (filo Firmicutes) nos utilizadores de IBP. A análise das fezes revelou de forma semelhante uma redução em Clostridiaceae e um aumento em Streptococcaceae 14.
Em geral, estes estudos indicam que os IBP afetam o microbioma humano. O significado clínico destes resultados justifica uma investigação mais aprofundada em estudos futuros.

Conclusão
O estômago humano apresenta um ambiente hostil para os microrganismos vivos, e a investigação recente continua a explorar se a microbiota do estômago é persistente ou se reflete apenas microrganismos transitórios. Apesar da sua importância clínica, a H. pylori desempenha um papel notável na formação do microbioma do estômago. A erradicação da H. pylori parece ter apenas um impacto temporário e reversível na composição dos microbiomas gástrico e intestinal. Os inibidores da bomba de protões (IBP) estão entre os medicamentos mais frequentemente consumidos. Estudos científicos indicam que os IBP alteram a estrutura do microbioma intestinal; no entanto, o significado clínico destas alterações requer uma investigação mais aprofundada.
O microbioma materno promove o desenvolvimento da placenta em ratinhos
ARTIGO COMENTADO - Fase adulta
Pelo Prof. Harry Sokol
Gastroenterologia e Nutrição,Hospital Saint-Antoine, Paris, França

Comentário ao artigo de Pronovost et al. (Science Advances 2023) [1]
O microbioma materno é um importante regulador da saúde gestacional, mas a forma como afeta a placenta, enquanto interface entre a mãe e o feto, continua por explorar. Aqui, os autores mostram que a microbiota intestinal materna promove o desenvolvimento da placenta em ratinhos. A depleção da microbiota intestinal materna limita o crescimento da placenta e altera a vascularização feto-placentária. A microbiota intestinal materna modula os metabolitos na circulação materna e fetal. Os ácidos gordos de cadeia curta (AGCC) estimulam a formação de tubos em células endoteliais em cultura e previnem a vascularização anormal da placenta em ratinhos deficientes em microbiota. Além disso, num modelo de desnutrição materna, a suplementação gestacional com AGCC previne a restrição do crescimento da placenta e a insuficiência vascular. Estes resultados sublinham a importância das simbioses hospedeiromicróbio durante a gravidez e revelam que o microbioma intestinal materno promove o crescimento e a vascularização da placenta em ratinhos.
O que é que já sabemos sobre isto?
Estudos recentes destacaram as influências significativas do microbioma materno no desenvolvimento da descendência a partir do período pré-natal 2, mas ainda não sabemos exatamente como o microbioma materno influencia a saúde materno-fetal durante a gravidez. Na intersecção entre a mãe e o feto encontra-se a placenta altamente vascularizada, que permite as trocas materno-fetais de nutrientes e gases necessários ao desenvolvimento fetal 3. Os autores examinaram os efeitos do microbioma intestinal materno no desenvolvimento da placenta em ratinhos, um órgão essencial que molda as trajetórias de saúde a longo prazo.
Quais são as principais conclusões deste estudo?
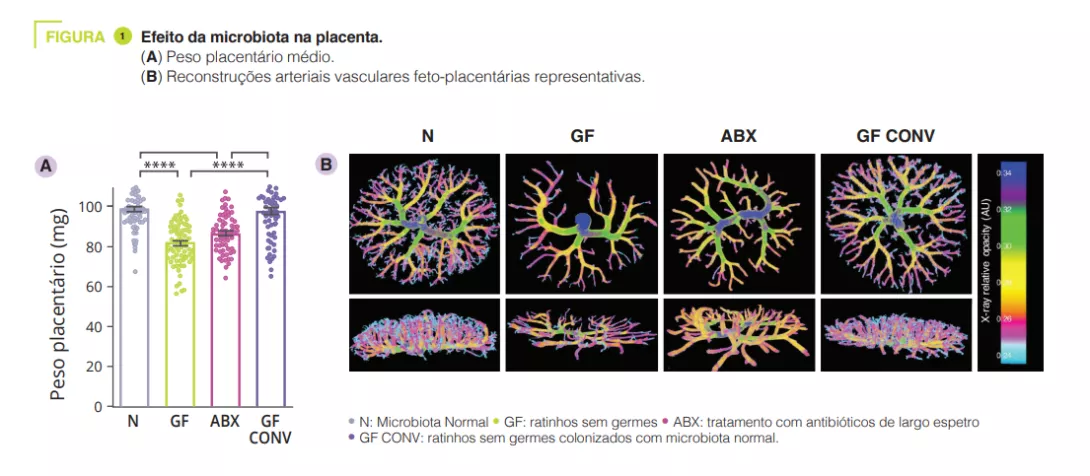
Para determinar os efeitos do microbioma intestinal materno no desenvolvimento da placenta, os autores começaram por criar ratinhos prenhes sem germe (GF) ou com depleção do microbioma intestinal através de antibióticos de largo espetro (ABX). A ausência ou depleção do microbioma intestinal materno resultou numa redução do peso da placenta em comparação com ratinhos com microbiota convencional e controlos GF colonizados com microbiota convencional, CONV) (figura 1). Consistente com as reduções no peso da placenta, o comprometimento do microbioma materno levou a reduções no volume total da placenta, bem como a uma redução no volume e na densidade do tecido no labirinto placentário, o principal local de troca materno-fetal. Para além da fisiopatologia placentária induzida pelo ABX na mãe, observámos diminuições correspondentes no peso e volume fetais. A vasculatura feto-placentária das mães deficientes em microbiota mostrou um volume e uma área vasculares reduzidos, com diminuições visíveis nos ramos vasculares, em comparação com os controlos (figura 1). Isto sugere que o microbioma materno controla o desenvolvimento vascular em alturas críticas durante a gestação. Dado que o microbioma materno regula muitos metabolitos circulantes, os autores colocaram a hipótese de que as deficiências na vascularização feto-placentária poderiam estar ligadas à microbiota e resultar de alterações em metabolitos-chave na circulação fetal. Os autores debruçaram-se especificamente sobre o papel dos ácidos gordos de cadeia curta (AGCC). Os AGCC são produzidos pela fermentação bacteriana de hidratos de carbono e estão significativamente reduzidos no soro materno e fetal de mães deficientes em microbiota.
Com base em investigações anteriores que demonstram que a suplementação materna com AGCC conduz a uma transferência direta de AGCC da circulação materna para a circulação fetal, os autores trataram as mães ABX com água suplementada com AGCC ou com água de controlo. Esta estratégia de suplementação aumentou significativamente as concentrações de butirato e propionato no sangue total do feto. O tratamento materno com AGCC aumentou o peso da placenta e corrigiu as alterações no crescimento da placenta em mães ABX para níveis comparáveis aos do controlo, com aumentos correspondentes no volume total da placenta e do labirinto. As células endoteliais da veia umbilical humana (HUVEC) foram então tratadas com AGCC em concentrações fisiológicas. Os AGCC de acetato e propionato aumentaram significativamente o comprimento dos ramos nas HUVEC em comparação com os controlos com veículo, enquanto o sinal do butirato foi menos claro. Este efeito foi dependente dos recetores de ácidos gordos livres 2 e 3 (FFAR2 e FFAR3). No contexto da desnutrição materna induzida pela restrição proteica, a suplementação materna com AGCC foi suficiente para restaurar o peso e o volume total da placenta e aumentar a vascularização feto-placentária.
Quais são as consequências práticas?
Este estudo demonstra o papel da microbiota intestinal materno na fisiologia e, nomeadamente, na vascularização da placenta. As deficiências vasculares placentárias estão associadas a uma diminuição do peso fetal, à pré-eclampsia e, na idade adulta, a um risco acrescido de numerosas patologias. As intervenções dirigidas à microbiota, principalmente através da nutrição, para incentivar a produção de AGCC, poderiam desempenhar um papel protetor.
- Globalmente, estes dados revelam o papel fundamental do microbioma intestinal materno na promoção do crescimento e desenvolvimento da placenta
- O microbioma materno é necessário para o desenvolvimento correto da vascularização feto-placentária
- Os AGCC promovem o crescimento da placenta e o desenvolvimento vascular, mesmo em condições de má nutrição materna
CONCLUSÃO
Este estudo revela que as funções metabólicas proporcionadas pelo microbioma intestinal materno durante a gravidez são essenciais para apoiar o crescimento e a vascularização da placenta em ratinhos. Uma melhor compreensão da forma como o microbioma intestinal materno afeta a estrutura e a função da placenta poderá levar ao desenvolvimento de novas abordagens destinadas a promover a saúde materna e fetal e a reduzir o risco de doenças crónicas.
Enteroccocus faecium B6 cultivado em crianças obesas promove a doença hepática esteatótica utilizando a tiramina como metabolito bioativo
ARTIGO COMENTADO - Rubrica pediátrica
Pelo Prof. Emmanuel Mas
Gastroenterologia e Nutrição, Hospital Saint-Antoine, Paris, França

Comentário ao artigo de Wei et al. (Gut Microbes 2024) [1]
Este artigo explora a relação entre a microbiota intestinal e a doença hepática gorda não alcoólica (NAFLD) em crianças obesas, no contexto do aumento global da obesidade infantil e da NAFLD. A metodologia baseia-se na análise multi-ómica e em estudos de coortes de crianças, combinados com experiências in vitro e in vivo. Os investigadores descobriram que Enterococcus faecium B6, isolado destas crianças, promove a NAFLD através da produção de tiramina, levando à acumulação de lípidos, inflamação e fibrose hepática. Estes resultados validam o papel causal desta bactéria na progressão da NAFLD e abrem caminho a abordagens terapêuticas baseadas em microrganismos e/ou nos seus metabolitos.
O que é que já sabemos sobre isto?
Como resultado da pandemia de obesidade, as doenças metabólicas de sobrecarga (NAFLD) tornaram-se a principal forma de lesão hepática, variando de esteatose e NASH (esteato-hepatite não alcoólica) a cirrose. A NAFLD afeta cada vez mais as crianças.
A fisiopatologia da NAFLD é complexa, mas pensa-se que a microbiota intestinal desempenha um papel importante. Os efeitos da microbiota intestinal poderiam ser mediados por vários metabolitos, em particular a tiramina.
Quais são as principais conclusões deste estudo?
Na primeira parte, foram incluídas 156 crianças obesas com idades compreendidas entre os 6 e os 18 anos, 78 com NAFLD e 78 com obesidade isolada. Os dois grupos diferiam em termos de parâmetros hepáticos e metabólicos. A diversidade microbiana alfa foi menor no grupo NAFLD; Enterococcus, Escherichia, Klebsiella, Dialister e Enterobacter foram mais abundantes no grupo NAFLD, enquanto Faecalibacterium, Eubacterium_eligens_group, Roseburia, Fusicatenibacter, Clostridium, Coprococcus e Parasutterella foram menos abundantes. O Enterococcus foi correlacionado com os níveis séricos de ALT, ASAT, triglicéridos e colesterol total.
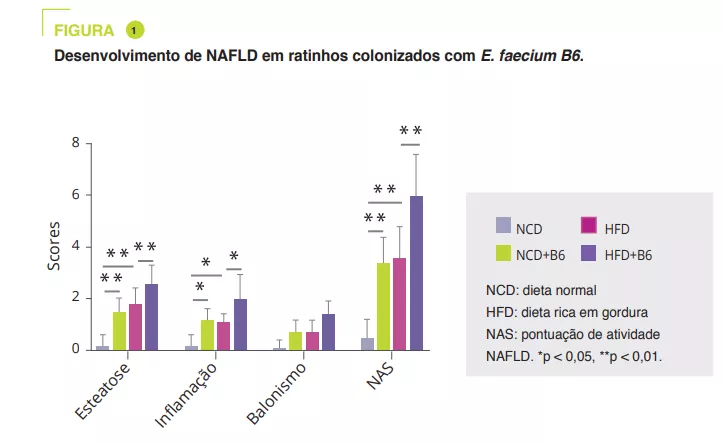
Após o isolamento de estirpes bacterianas de crianças obesas com NAFLD, a E. faecium B6 mostrou, em cultura de células, uma capacidade de acumular lípidos. Um estudo em murinos comparou uma dieta normal (NCD) ou uma dieta enriquecida em gordura (HFD), com ou sem B6, durante 12 semanas. Embora a E. faecium B6 não tenha tido qualquer efeito no peso corporal, agravou os danos no fígado causados pela sobrecarga, tanto a nível biológico como histológico (figura 1).
A análise transcriptómica revelou que a E. faecium B6 modificou a expressão de genes envolvidos no metabolismo lipídico, na inflamação e na fibrose, tais como as vias de sinalização PPAR, quimiocina, NF-kB e TGF-b e o metabolismo do ácido linoleico. Relativamente ao metabolismo lipídico, verificou-se um aumento da expressão do ARNm e da proteína do PPARγ e do CD36 e uma diminuição da expressão do CPT-1α. Os autores evidenciaram um aumento da expressão de citocinas inflamatórias (TNF-α, IL-6, IL-1β) e de proteínas envolvidas na fibrose (TGF-β e α-SMA) (figura 2).
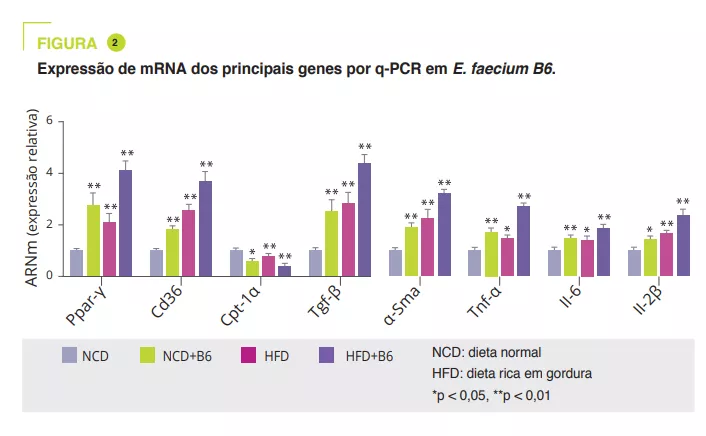
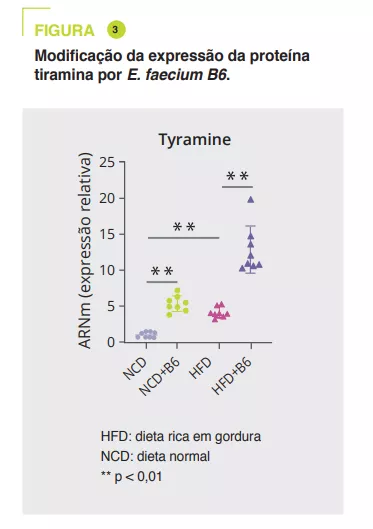
Utilizando soro murino, uma análise alargada e não direcionada por espetrometria de massa em tandem mostrou que a E. faecium B6 aumentou ou diminuiu os metabolitos nos regimes NCD (30 e 85) ou HFD (18 e 45). A alteração mais marcada foi o aumento da tiramina (figura 3). Uma análise mais aprofundada sugere que a E. faecium B6 tem a capacidade de produzir tiramina. Além disso, o tratamento com tiramina de ratinhos com dieta NCD ou HFD reproduz o desenvolvimento de NAFLD, sem efeito no peso como o E. faecium B6, e modifica de forma semelhante a expressão de genes que codificam PPARγ, CD36, CPT-1α, TNF-α, IL-6, IL-1β, TGF-β e α-SMA.
Por fim, os autores confirmaram estes resultados em 123 crianças obesas com NAFLD e 123 controlos. Os níveis de E. faecium B6 e do gene que codifica a tiramina (mfnA) eram mais elevados no grupo com NAFLD. Estes níveis foram correlacionados com marcadores biológicos de NAFLD (ASAT, ALAT, triglicéridos, colesterol total e LDL) e citocinas inflamatórias (TNF-α, IL-6, IL-1β).
Quais são as consequências práticas?
Este estudo confirma a importância da microbiota intestinal no desenvolvimento da NAFLD e abre novas perspetivas terapêuticas. Para além do Enterococcus faecium B6 e da tiramina, o PPARγ poderia desempenhar um papel central na ligação entre a acumulação de lípidos, a inflamação e a fibrose.
- A E. faecium B6, uma bactéria isolada de crianças obesas com NAFLD, agrava a doença ao produzir um metabolito bioativo, a tiramina
- A E. faecium B6 e a tiramina reproduzem de forma semelhante a NAFLD em ratinhos com uma dieta normal rica em gorduras
CONCLUSÃO
Este estudo identificou Enterococcus faecium B6 como uma estirpe que promove o desenvolvimento de NAFLD em crianças obesas. Esta bactéria produz um metabolito bioativo, a tiramina, que medeia estes efeitos através da ativação da via de sinalização PPARγ
Destaques do congresso DDW
Pelo Dr. Purna C. kashyap
Divisão de Gastroenterologia e Hepatologia, Programa de Microbiómica,
Bernard e Edith Waterman, Centro de Medicina Individualizada,
Faculdade de Medicina da Mayo Clinic, Rochester, EUA

Em maio de 2024, mais de 13.000 profissionais interessados em doenças digestivas de mais de 100 países participaram na Semana Anual das Doenças Digestivas. A reunião patrocinada pela Associação Americana de Gastroenterologia (AGA), Associação Americana para o Estudo das Doenças do Fígado (AASLD), Sociedade Americana de Endoscopia Gastrointestinal (ASGE) e Sociedade para a Cirurgia do Trato Alimentar (SSAT) incluiu mais de 400 palestras originais e 4.300 resumos orais e sessões de posters abrangendo inovação e investigação de ponta em áreas de doenças gastrointestinais e hepáticas. A secção dedicada ao Microbioma e à Terapia Microbiana e o Centro de Educação e Investigação do Microbioma Intestinal da AGA acolheram 11 sessões científicas com 33 palestras convidadas de especialistas internacionais de renome e 52 apresentações de resumos orais que destacam a investigação de ponta e a inovação na ciência do microbioma. Veja abaixo um resumo de algumas das principais apresentações.
Microbioma e cancro
A palestra inaugural sobre o microbioma, da autoria de Gail Hecht e David Hecht, foi proferida pela Dra. Jennifer Wargo. A Dra. Wargo apresentou dados sobre o microambiente tumoral, o microbioma intestinal no cancro, biomarcadores microbianos da resposta ao tratamento e novas estratégias que visam o tecido, o tumor e o microbioma intestinal para intercetar e prevenir o cancro. A Dra. Wargo resumiu as descobertas que demonstram que a diversidade e a composição do microbioma intestinal e tumoral são marcadores de prognóstico cruciais para os resultados do cancro, particularmente após transplantes de células estaminais e em doentes que recebem imunoterapia.

Probióticos
A Dra. Wargo apresentou dados que sugerem que alguns probióticos podem levar a piores resultados em termos de cancro num subconjunto de doentes, uma conclusão também observada em modelos animais 1 (Spencer et al., Science, 2021). No entanto, um produto bacteriano vivo , CBM588, combinado com o bloqueio de CTLA4 e PD1, mostrou benefícios no tratamento do carcinoma de células renais metastático 2. Além disso, foi demonstrado que bactérias comensais como a Bifidobacterium promovem a imunidade antitumoral e aumentam a eficácia de tratamentos como o bloqueio de PD-L1 e CTLA4, destacando a necessidade de abordagens probióticas personalizadas e direcionadas.
Antibióticos
À semelhança dos probióticos, os doentes que receberam antibióticos antes do tratamento com inibidores do ponto de controlo imunitário tiveram piores resultados 3. Por outro lado, as abordagens antibióticas direcionadas, como a utilização de ciprofloxacina ou metronidazol para atingir as bactérias intratumorais que medeiam a resistência ao tratamento do cancro 4, 5, podem melhorar a imunidade antitumoral e as respostas ao tratamento
Transplante de microbiota fecal (FM)
O FMT está a emergir como uma abordagem promissora no tratamento do cancro. Pequenos ensaios clínicos abertos mostraram que o FMT pode ultrapassar a resistência à imunoterapia em doentes com melanoma metastático 6, 7. O FMT de dadores saudáveis, combinado com o tratamento anti-PD1 em doentes com melanoma metastático sem tratamento prévio, tem sido associado a elevadas taxas de resposta.
A alimentação e o microbioma
A alimentação desempenha um papel crucial na modulação do microbioma intestinal e influencia os resultados do tratamento do cancro. Os doentes que consumiram mais de 20 gramas de fibra por dia tiveram melhores resultados com o bloqueio do ponto de controlo imunitário 1. Os estudos em curso que utilizam estratégias de gestão da dieta rica em fibras e outras estratégias individualizadas são promissores na melhoria das respostas ao tratamento do cancro.

Prebióticos
A Dra. Wargo partilhou resultados encorajadores de intervenções como a dieta enriquecida com alimentos prebióticos (PreFED) e fontes alimentares prebióticas como o feijão no ensaio BEGONE, que mostram como os prebióticos podem modular os micróbios intestinais e reduzir a inflamação sistémica. Além disso, a Dra. Tessa Anderman discutiu as lições aprendidas com um ensaio de prebióticos em doentes submetidos a transplante alogénico de células hematopoiéticas (allo-HCT). A eficácia dos prebióticos e a produção de ácidos gordos de cadeia curta variam em função do prebiótico utilizado e da composição da microbiota do indivíduo, o que sugere que uma combinação de diferentes prebióticos pode ser mais eficaz na promoção da saúde.
Terapêutica do microbioma
A Dra. Colleen Kelly descreveu as recomendações feitas pela diretriz de prática clínica da AGA sobre terapias baseadas na microbiota fecal para doenças gastrointestinais. Em adultos imunocompetentes, a AGA sugere o uso de terapias baseadas na microbiota fecal após a conclusão do tratamento padrão com antibióticos, mas em adultos leve ou moderadamente imunocomprometidos com infeção recorrente por C. difficile, ou adultos hospitalizados com infeção grave ou fulminante por C. difficile que não respondem ao tratamento padrão. Além disso, a AGA sugere a utilização de um transplante convencional de microbiota fecal após a conclusão do tratamento antibiótico padrão. Em adultos com colite ulcerosa, doença de Crohn, pouchite ou síndrome do intestino irritável, a AGA sugere contra o uso de transplante convencional de microbiota fecal, exceto no contexto de ensaios clínicos. A Dra. Jessica Allegretti descreveu o estado atual das terapias baseadas na microbiota fecal, referindo as recentes actualizações da FDA, em que é necessário um pedido de investigação de um novo medicamento quando se utilizam produtos de fezes em bancos e um rastreio mais abrangente dos dadores, incluindo o rastreio de SarsCov-2 e de bactérias produtoras de betalactamases de espetro alargado (ESBL), dado que foi notificada uma infeção sistémica com bactérias ESBL após o FMT em dois doentes imunocomprometidos. O panorama do tratamento da infeção por C. difficile está a evoluir rapidamente com a aprovação pela FDA de dois novos produtos de microbiota fecal para a prevenção de CDI recorrente, REBYOTA (microbiota fecal, viva - jslm) como uma instalação rectal de dose única ou VOWST (esporos de microbiota fecal, vivos-brpk) 4 cápsulas tomadas por via oral uma vez por dia durante 3 dias consecutivos, 3-4 dias após os antibióticos padrão de tratamento, bem como um ensaio de fase III em curso de um consórcio bacteriano vivo racionalmente definido, não derivado de fezes de dador.
Um debate moderado sobre o papel dos probióticos nas doenças gastrointestinais incluiu uma análise exaustiva da utilização de probióticos em adultos e crianças. A discussão centrou-se no caminho a seguir e, embora os probióticos pareçam não ser eficazes nas perturbações gastrointestinais dos adultos quando se considera a literatura geral, os seus efeitos variam consoante a espécie e a estirpe e alguns doentes podem beneficiar deles. Além disso, os alimentos fermentados caseiros como o iogurte, o kimchi e o kefir foram discutidos como alternativas económicas. As diferenças nas recomendações de diferentes sociedades científicas relativamente à utilização de probióticos parecem resultar de diferentes metodologias e dos tipos de estudos clínicos que são considerados na elaboração das recomendações. Os testes diretos ao microbioma do consumidor estão a ganhar popularidade entre os doentes, especialmente para orientar a terapêutica probiótica, mas o painel concluiu que, atualmente, não há benefícios clínicos comprovados, pelo que não devem ser recomendados. No entanto, existe um potencial para utilizações futuras, como o rastreio das alterações do microbiota de um indivíduo após intervenções. Um tema central que emergiu de todas estas discussões centrou-se na necessidade de abordagens personalizadas à terapêutica do microbioma.
Os primeiros mil dias: um período crucial para a microbiota
Pela Dr. Marta Ardila Jimenez
Coordenadora, Departamento de Pediatria e Neonatalogia, Clínica de Marly Jorge Cavelier Gaviria, Bogotá, Colômbia

No 56.º congresso da ESPGHAN, em Milão, a microbiota foi um dos principais protagonistas do congresso, graças ao crescente número de estudos em ascensão e à necessidade imperativa de aprender mais sobre este tópico todos os dias. Estamos a viver numa nova era em que a microbiota desempenha um papel fundamental na forma como cumpriremos o nosso dever de reduzir as taxas de doença para as gerações futuras. Mas como colegas médicos, como é que podemos ensinar esta informação aos nossos doentes de forma a prevenir doenças constantes?
Ao refletir sobre a forma como determinadas estratégias podem ter impacto na evolução do peso da doença na população em geral, numerosos esforços de investigação provaram que os primeiros 1000 dias de vida são um período de tempo crítico que representa a oportunidade de causar uma intervenção positiva e prevenir uma vida inteira de doenças não transmissíveis. Porque é que é tão importante? Bem, este período é fundamental para a colonização intestinal e, subsequentemente, para o estabelecimento da microbiota. Por conseguinte, tem um controlo significativo sobre a maturação intestinal e a programação metabólica e imunológica. A colonização microbiana do trato gastrointestinal está fundamentalmente ligada à programação metabólica e à maturação imunológica. Quaisquer perturbações na colonização durante a infância têm sido associadas a um risco acrescido de múltiplas doenças, incluindo asma, dermatite atópica, alergia alimentar, diabetes, doença inflamatória intestinal e obesidade.1
Desde o início da fase embrionária, as taxas de desenvolvimento e crescimento são determinadas não só pela carga genética, mas também pelos fatores ambientais a que a criança vai estar exposta. Os mecanismos epigenéticos, como a modificação das histonas, o ARN não codificante e a metilação do ADN, são fortemente afetados por estes fatores críticos, como o consumo de substâncias específ cas, certas dietas e grandes quantidades de stress. Todas as fases de crescimento e desenvolvimento são cruciais para determinar os efeitos positivos que a microbiota pode ter num doente, tal como um puzzle que requer todas as suas peças para estar completo.

Estudos realizados sobre a microbiota durante o período de gestação mostram alterações na composição macrobiótica da mãe em vários locais do corpo, incluindo o endométrio, a vagina e o intestino, em alguns casos causando mesmo complicações na gravidez. À medida que avançamos durante o primeiro trimestre de gravidez, a constituição intestinal da microbiota é semelhante à de mulheres saudáveis não grávidas 2. Ao longo do terceiro trimestre a diversidade da microbiota aumenta exponencialmente, provocando algum aumento de peso, insensibilidade à insulina, maior concentração de citocinas fecais, o que se reflete em inflamação. Também se registam níveis mais elevados de bacteroides e estafilococos nas fezes de grávidas com excesso de peso, em comparação com as que mantêm um peso saudável. A transição vertical das bactérias da mãe para o recém-nascido contribui para o desenvolvimento da microbiota no trato intestinal e pode afetar a função e o crescimento desse sistema imunitário específico. Surpreendentemente, vários estudos mostram que as crianças nascidas de cesariana têm mais hipóteses de sofrer de doenças imunitárias, como alergias e asma. É no momento do primeiro contacto pele a pele que a amamentação desempenha um papel crucial no enriquecimento do recém-nascido com vários nutrientes que ajudarão a preservar o seu sistema imunitário 3, 4.
O momento da introdução de alimentos sólidos também influencia a composição da microbiota intestinal. Em bebés pré-termo, o desenvolvimento da microbiota intestinal é influenciado por múltiplos fatores, incluindo o tempo decorrido desde o nascimento e a ingestão de leite materno, e intervenções como a suplementação com probióticos e prebióticos mostram resultados promissores na redução da morbilidade e mortalidade nesta população.
Tendo um entendimento claro de como esses primeiros mil dias impactam a vida do recém-nascido quando adulto, nossa missão será conduzir políticas públicas para fortalecer a microbiota. Podemos atingir este objetivo através de ações que vão desde o cuidado e carinho a uma mãe lactante, passando pelo incentivo à prática do aleitamento materno e, mais importante ainda, pela comunicação e divulgação de informação sobre hábitos nutricionais saudáveis a todos os nossos doentes.
Microbiota intestinal #22
Pela Prof. Satu. Pekkala
Investigador na Academia da Finlândia, Faculdade de Ciências
do Desporto e da Saúde, Universidade de Jyväskylä, Finlândia

Ligações do microbioma a futuras perturbações do desenvolvimento neurológico na infância
As perturbações do neurodesenvolvimento (ND), como a perturbação do espetro do autismo (PEA), têm um impacto grave no sistema nervoso central. Frequentemente, os indivíduos com PEA apresentam sintomas gastrointestinais (GI), o que pode ser explicado por uma disfunção do eixo intestino-cérebro. No entanto, a forma como o microbioma pode afetar o desenvolvimento do ND continua por esclarecer. Este estudo acompanhou uma coorte de nascimentos sueca (n=16.440) durante mais de 20 anos e estudou as associações de vários biomarcadores, incluindo a microbiota, com o futuro diagnóstico de ND. Entre os fatores de risco de ND no início da vida, foram identificadas infeções e exposição a antibióticos, especialmente em indivíduos com PEA. Além disso, várias espécies da microbiota intestinal, nomeadamente as pertencentes ao filo Firmicutes, foram associadas a problemas gastrointestinais. As crianças com episódios frequentes de otite tinham maior probabilidade de desenvolver PEA, enquanto a exposição a substâncias químicas nocivas predispunha para a perturbação do défice de atenção/hiperatividade (PHDA). O metaboloma e o lipidoma do soro do cordão umbilical, bem como o metaboloma das fezes, foram explorados em PEA à nascença e com 1 ano de idade. Foi detetada uma diminuição de lípidos cruciais, como o ácido α-linolénico e os ácidos biliares, que podem indicar inflamação, em recém-nascidos com PEA futura. O início da disbiose microbiana intestinal ocorreu cedo na vida e foi associado, por exemplo, a ácidos gordos e precursores de neurotransmissores. A Akkermansia muciniphila, benéfica para a saúde e imunomoduladora, estava ausente em bebés posteriormente diagnosticados com PEA, mas não estava associada a uma futura PHDA. Os géneros Akkermansia e Coprococcus, que se encontravam reduzidos em bebés com futuros distúrbios neurodegenerativos, associaram-se positivamente aos precursores de neurotransmissores fecais e às vitaminas essenciais.
Em conclusão, todos os resultados deste estudo sugerem que as origens precoces das doenças neurodegenerativas são mediadas pela microbiota intestinal. Este facto fornece uma base para o desenvolvimento de intervenções precoces para as doenças neurodegenerativas e pode servir de ferramenta para prever as doenças neurodegenerativas no início da vida.
A relação causal entre o microbiota intestinal e as doenças imunitárias da pele
Um número crescente de estudos refere que muitas doenças de pele estão relacionadas com o equilíbrio geral do organismo, incluindo a homeostasia da microbiota intestinal. A psoríase (PSO), a dermatite atópica (DA), a acne e o líquen plano são as doenças de pele mais comuns. A PSO e a DA têm sido associadas à saúde gastrointestinal, e muitos estudos mostraram associações entre a acne e o desequilíbrio da microbiota intestinal. No entanto, ainda não é claro se
estas associações refletem uma relação causal.
Neste estudo, foram extraídos de bases de dados públicas dados completos de associações genéticas para microbiota intestinal, psoríase, dermatite atópica, acne e líquen plano. Em seguida, os autores usaram a análise de randomização mendeliana (MR) bidirecional de duas amostras para investigar a possível relação causal entre a microbiota intestinal e as doenças de pele. Um total de 18.340 indivíduos foi incluído no estudo, e foram identificados polimorfismos de nucleótido único (SNPs) significativos ao nível do genoma associados aos taxa MI.
Os autores verificaram que havia cinco géneros associados no grupo da PSO, sete géneros associados no grupo da DA, um total de dez géneros associados no grupo da acne e quatro géneros associados no grupo do líquen plano. No entanto, quando os resultados foram corrigidos para a taxa de falsa descoberta, apenas a relação causal entre o grupo Eubacterium fissicatena e a PSO permaneceu significativa. Considerando a validação cruzada com os resultados anteriores, a análise MR inversa não apresentou os mesmos resultados que a anterior.
Os autores concluem que os seus resultados mostraram uma relação causal entre a microbiota intestinal e as doenças cutâneas imunes e fornecem uma nova perspetiva terapêutica para o estudo das doenças imunes. No entanto, apenas o grupo do género Eubacterium fissicatena mostrou uma relação significativa com uma das doenças de pele estudadas.
Alterações longitudinais do microbioma intestinal no melanoma avançado tratado com bloqueadores dos pontos de controlo imunitário
O bloqueio dos pontos de controlo imunitário (ICB) prolonga a sobrevivência de doentes com diferentes tipos de cancro em fases avançadas. No entanto, apenas um subconjunto de doentes responde ao ICB, o que pode estar relacionado com o microbioma intestinal, mas os estudos transversais no terreno apresentam resultados inconsistentes. Por conseguinte, são necessários estudos longitudinais. Neste estudo, 175 doentes foram tratados com ICB para melanoma avançado e o microbioma foi analisado com sequenciação shotgun durante as primeiras 12 semanas de tratamento. Em última análise, a sobrevivência livre de progressão (PFS) foi designada como o tempo decorrido desde a imunoterapia inicial até à progressão da doença ou morte, e os doentes com uma PFS de 12 meses ou mais foram comparados comos doentes com uma PFS inferior a 12 meses.
Os resultados mostram que os pacientes com PFS < 12 meses apresentaram maiores abundâncias de taxa que foram associados a doenças inflamatórias. Pelo contrário, vários taxa considerados como “pró-inflamatórios” foram enriquecidos em pacientes com PFS ≥ 12 meses. Curiosamente, cinco taxa foram consistentemente mais elevados em pacientes com PFS ≥ 12 meses. Nomeadamente, grupo A. butyriciproducens, I. bartlettii, Dorea sp. AF24 7LB, L. grupo gasseri e L. celerecrescens foram mais elevados em PFS ≥ 12 meses, enquanto outros quatro taxa foram consistentemente mais elevados em doentes com PFS < 12 meses (R. lactatiformans, R. grupo SGB15265 não classificado, P. copri clade A e uma espécie não identificada do filo Bacteroidetes).
De seguida, os autores testaram a generalização dos resultados utilizando seis coortes de melanoma independentes. Apenas na coorte com um número razoavelmente grande de doentes (N = 112) conseguiram discriminar entre doentes com PFS ≥ 12 e PFS < 12 meses.
Os autores concluem que o seu estudo sublinha a natureza dinâmica do microbioma intestinal e indica que a caraterização longitudinal é fundamental para orientar intervenções direcionadas para o microbioma, a fim de melhorar os resultados do tratamento no melanoma avançado.
Microbiota vaginal #22
Pela Prof. Satu. Pekkala
Bolseiro de Investigação da Academia da Finlândia,
Faculdade de Ciências do Desporto e da Saúde, Universidade de Jyväskylä, Finlândia

Menopausa: uma microbiota vaginal desequilibrada pode promover a inflamação
Durante a pré-menopausa (período que antecede a cessação definitiva da menstruação), a diminuição dos níveis de estrogénio leva a uma redução do teor de glicogénio das células da mucosa, sendo o glicogénio o alimento preferido dos Lactobacillus. Menos bem nutridos, os Lactobacillus tornam-se menos abundantes e perdem a sua posição dominante na flora, o que pode levar a desequilíbrios na microbiota vaginal. A redução das hormonas sexuais está também associada a um aumento prejudicial da diversidade microbiana.
Vários estudos demonstraram que a perda da dominância dos Lactobacillus e o aumento da diversidade bacteriana estão associados a uma inflamação da mucosa vaginal. A inflamação aumenta o risco de infeção, nomeadamente de infeções sexualmente transmissíveis (IST), e de lesões pré-cancerosas do colo do útero. Embora a ligação entre as alterações da microbiota vaginal e a inflamação tenha sido demonstrada em mulheres na pré-menopausa, ainda não foi efetuado nenhum estudo para determinar se persiste no período pós-menopausa.
Para documentar esta situação, uma equipa de investigadores americanos utilizou dados de 119 mulheres pós-menopáusicas (idade média de 61 anos) que tinham participado num ensaio clínico que comparava os efeitos do estrogénio ou de umcreme hidratante na flora vaginal. Analisaram as populações bacterianas e os marcadores de inflamação (citocinas) nos fluidos vaginais das voluntárias para determinar se estes dois parâmetros estavam relacionados. Verificaram que as mulheres cujo microbiota vaginal era mais diversificado, ou mais pobre em Lactobacillus, apresentavam níveis mais elevados de citocinas. Estas duas caraterísticas da microbiota vaginal estão, portanto, associadas à inflamação, tal como acontece nas mulheres na pré-menopausa.
Estes resultados são interessantes, pois sugerem que talvez um dia seja possível, através da modulação da microbiota vaginal das mulheres pós-menopáusicas, limitar a inflamação da mucosa vaginal e, assim, atuar preventivamente para preservar a sua saúde.
Observatório Internacional do Microbiota 2ª edição
Pelo Biocodex Microbiota Institute e IPSOS
A consciência da importância da microbiota para a saúde está a começar
a aumentar, mas ainda há um longo caminho a percorrer. Os profissionais
de saúde têm um papel fundamental a desempenhar na educação e informação!
Pelo segundo ano consecutivo, o Instituto Biocodex do Microbiota encomendou à Ipsos um grande inquérito internacional sobre a microbiota: o Observatório Internacional do Microbiota. O inquérito foi realizado pela Ipsos junto de 7.500 pessoas em 11 países (França, Espanha, Portugal, Polónia, Finlândia, Marrocos, Estados Unidos, Brasil, México, China e Vietname). Em cada país, a amostra inquirida é representativa da população do país com 18 anos ou mais, em termos de sexo, idade, profissão e região. O inquérito foi realizado através da Internet entre 26 de janeiro e 26 de fevereiro de 2024. Eis as principais conclusões.
11 PAÍSES
7,500 RESPONDENTES
O conhecimento sobre a microbiota e o seu papel está a progredir em todo o mundo, mas continua a ser uma parte do corpo que é muitas vezes mal compreendida
- Este ano, apenas 1 em cada 5 pessoas afirma saber exatamente o que significa o termo “microbiota” (23%), mas o conhecimento do termo está a aumentar (+3 pontos em relação a 2023). Globalmente, 7 em cada 10 pessoas já ouviram falar da microbiota (+7 pontos em relação a 2023)
- O conhecimento da diversidade das microbiotas continua a ser limitado, mas também melhorou em relação ao ano passado. A microbiota intestinal continua a ser o microbiota mais conhecido: 26% sabem exatamente o que é (+2 pontos em relação a 2023). Seguem-se a microbiota vaginal (20%, +3 pontos em relação a 2023), a microbiota oral (20%, +2 pontos em relação a 2023), a microbiota da pele (17%; +1 ponto em relação a 2023) e o microbiota urinário (16%, +2 pontos em relação a 2023).
- O papel e as funções da microbiota também são mais conhecidos do que no ano passado: 78% sabem que a sua alimentação tem um impacto no equilíbrio da sua microbiota (+2 pontos em relação a 2023).
- No entanto, ainda temos um longo caminho a percorrer, nomeadamente em termos de conhecimento das caraterísticas e da composição da microbiota. Menos de 1 em cada 2 pessoas sabe que a microbiota não se encontra exclusivamente no intestino (46%, +1 ponto em relação a 2023) e apenas metade dos inquiridos sabe que a microbiota permite que o intestino transmita ao cérebro informações essenciais para a saúde (53%, idêntico a 2023).

As pessoas estão a começar a mudar o seu comportamento para manter uma microbiota equilibrada
- Mais de metade da população inquirida (58%) afirma já ter alterado o seu comportamento para melhor proteger o equilíbrio e o bom funcionamento da sua microbiota. No entanto, esta consciencialização deve ser relativizada: apenas 17% o fazem muito”, sendo que 2 em cada 5 afirmam fazê-lo apenas “um pouco” (41%).
- A grande maioria dos inquiridos afirma ter adotado comportamentos adequados, embora muitas vezes admitam que o fazem apenas parcialmente. Uma grande maioria afirma ter uma alimentação equilibrada e variada (84%, mas apenas 33% o fazem completamente), ser fisicamente ativo (78%, mas apenas 35% o fazem completamente), evitar fumar (76%) ou limitar os alimentos processados (75%, mas apenas 26% o fazem completamente) para limitar o risco de um microbiota desequilibrado.
- Por outro lado, certos comportamentos mais especificamente ligados à proteção da microbiota do organismo não foram suficientemente adotados. 59% dizem que tomam banho ou duche várias vezes por dia, prática suscetível de provocar disbiose (desequilíbrio na composição da microbiota que pode levar a numerosos problemas de saúde), e 42% das mulheres praticam a ducha vaginal, apesar de esta ser prejudicial para a sua microbiota vaginal.
Uma “idade de ouro para a microbiota”? Os pais e os jovens entre os 25 e os 44 anos são os mais informados sobre a microbiota, em contraste com os seniores
- Os pais de crianças com menos de 3 anos e o grupo etário 25-44 anos estão mais conscientes e informados: esta é a “idade de ouro da microbiota”.
- Estas populações têm um maior conhecimento da microbiota: 76% dos pais de crianças com menos de 3 anos, 78% das pessoas com idades compreendidas entre os 25 e os 34 anos e 75% das pessoas com idades compreendidas entre os 35 e os 44 anos já ouviram falar do termo “microbiota” (contra 70% em geral).
- Os pais de crianças pequenas (68%), os que têm entre 25 e 34 anos (67%) e os que têm entre 35 e 44 anos (63%) são também os que mais afirmam ter modificado o seu comportamento para proteger o equilíbrio e o bom funcionamento da sua microbiota (contra 58% no total).
- Este facto deve-se em parte ao papel dos profissionais de saúde na sensibilização. Assim, 58% dos pais de crianças com menos de 3 anos, 55% dos pais com idades compreendidas entre os 25 e os 34 anos e 47% dos pais com idades compreendidas entre os 35 e os 44 anos receberam explicações dos seus profissionais de saúde sobre o que é a microbiota, o seu papel e as suas funções (contra 45% no total).
- Por outro lado, apesar de a sua idade os expor a problemas de saúde recorrentes, os idosos são o grande grupo etário esquecido no que diz respeito à microbiota.
- O seu conhecimento da microbiota é menor: apenas 61% das pessoas com 60 anos ou mais já ouviram falar da microbiota (contra 70% em geral).
- O assunto é pouco discutido com os profissionais de saúde: apenas um terço dos idosos recebeu informações de profissionais de saúde sobre a microbiota e o seu papel e funções (34%, contra 45% no total).

Reconhecidos pela população mundial como a fonte de informação mais fiável sobre a microbiota, os profissionais de saúde têm um papel crucial a desempenhar para incentivar os seus pacientes a adotar os comportamentos corretos
- Os profissionais de saúde são a fonte de informação mais credível: mais de 3 em cada 4 inquiridos consideram que os profissionais de saúde são a fonte de informação mais fiável sobre a microbiota (78%; primeira fonte mencionada).
- Em comparação com o ano passado, as pessoas estão mais conscientes da microbiota graças aos seus profissionais de saúde, uma evolução encorajadora. Consequentemente, 45% receberam uma explicação sobre o que é a microbiota, um indicador que é 6 pontos mais elevado do que em 2023.
- Esta sensibilização dos profissionais de saúde é tanto mais importante quanto tem um grande impacto nos conhecimentos e no comportamento dos doentes. De facto, as pessoas que receberam repetidamente informações de um profissional de saúde sobre a microbiota compreendem-no melhor (53% sabem exatamente o que é, contra 23% no geral). É também mais provável que tenham alterado o seu comportamento para manter um microbiota equilibrado (95%, contra 58% no geral).

Encontrar todos os resultados
Cada tipo de infertilidade tem a sua própria disbiose vaginal?
O papel da microbiota vaginal na infertilidade foi confirmado: não apenas a disbiose varia com o tipo de infertilidade, mas as coinfecções bacterianas e virais podem contribuir cumulativamente para a infertilidade.

A infertilidade, que afeta cerca de 15% dos casais em idade fértil, parece estar fortemente ligada a uma disbiose da microbiota vaginal.
No entanto, poucos estudos efetuados até então se concentraram nas diferenças da microbiota vaginal entre mulheres com infertilidade primária (incapacidade de engravidar após 12 meses de tentativa) e infertilidade secundária (dificuldade de engravidar novamente após a primeira gravidez).
Assim, trabalhos recentes 1 buscaram caracterizar a microbiota vaginal disbiótica e a sua relação com a infertilidade em 136 mulheres mexicanas diagnosticadas com infertilidade primária (58 participantes) ou secundária (78 participantes).
17,5% A infertilidade afeta cerca de 17,5% da população adulta, ou seja, uma em cada seis pessoas em todo o mundo. A sua prevalência varia pouco de uma região para outra ou em função da riqueza de um país. ²
48 milhões A infertilidade afeta 48 milhões de casais em todo o mundo. As causas, por vezes inexplicáveis, incluem fatores hormonais, genéticos ou ambientais que afetam tanto os homens como as mulheres. ³
O efeito da idade
A análise das amostras de esfregaços vaginais mostra que a idade é o primeiro fator que explica a tipologia da flora vaginal das mulheres estudadas.
A idade também foi positivamente correlacionada com a infertilidade primária (as pacientes mais velhas foram mais afetadas) e inversamente correlacionada com a infertilidade secundária.
No entanto, como lembrado pelos investigadores, a microbiota vaginal evolui ao longo da vida, incluindo um declínio nos Lactobacillus protetores e uma maior sensibilidade à disbiose. Assim, os investigadores levantam a hipótese (ainda a ser validada) de que as alterações da microbiota poderiam explicar as dificuldades de conceção, naturais ou assistidas e, por conseguinte, o aumento da prevalência da infertilidade primária nas mulheres mais velhas.
Prever o risco de prematuridade através da microbiota vaginal?
Duas infertilidades, duas microbiotas
Além disso, a análise das microbiotas vaginais revela uma menor predominância de lactobacilos nas mulheres afetadas pela infertilidade, em comparação com a flora das mulheres férteis.
Mas, acima de tudo, salienta as diferenças entre as mulheres que sofrem de infertilidade primária e secundária.
- Nas mulheres com infertilidade primária, predominam as bactérias benéficas, os Lactobacillus crispatus e os Lactobacillus gasseri, mas os investigadores também observam uma elevada proporção de Gardnerella vaginalis e de Fannyhessea vagina, bactérias também envolvidas na vaginose. E a presença de G. vaginalis está fortemente associada à presença de HPV.
- Nos casos de infertilidade secundária, a presença de G. vaginalis é acompanhada pela presença do vírus Epstein-Barr ou até mesmo do Haemophilus influenzae. As bactérias sexualmente transmissíveis, algumas das quais já estão associadas à infertilidade, também estão mais presentes: Ureaplasma parvum, Ureaplasma urealyticum, Mycoplasma hominis e Chlamydia trachomatis.
Duas vias de investigação
Estes resultados sugerem que a composição da microbiota vaginal pode desempenhar um papel decisivo na infertilidade e abrem caminho para terapias personalizadas baseadas em alterações da microbiota vaginal.
Além disso, as coinfecções bacterianas e virais parecem exacerbar a disbiose e contribuir cumulativamente para a infertilidade. O que explica o interesse de estudos que incluam não apenas avaliações bacterianas, mas também virais e fúngicas, para compreender completamente o papel da microbiota na infertilidade.
 Aborto: a disbiose vaginal no banco dos réus?
Aborto: a disbiose vaginal no banco dos réus?
 Uma nova investigação revela que as bactérias vaginais influenciam a colonização por Streptococcus do Grupo B durante a gravidez
Uma nova investigação revela que as bactérias vaginais influenciam a colonização por Streptococcus do Grupo B durante a gravidez