El microbioma materno favorece el desarrollo de la placenta en ratones
ARTÍCULO COMENTADO - Adulto
Por el Pr. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia

Comentario del artículo de Pronovost et al. Science Advances 2023 [1]
El microbioma materno es un importante regulador de la salud gestacional, pero aún no se ha explorado cómo afecta a la placenta como interfaz entre madre y feto. Los autores muestran aquí que la microbiota intestinal materna favorece el desarrollo de la placenta en ratones. El empobrecimiento de la microbiota intestinal materna limita el crecimiento de la placenta y altera la vascularización fetoplacentaria. La microbiota intestinal materna modula los metabolitos en la circulación materna y fetal. Los ácidos grasos de cadena corta (AGCC) estimulan la formación de tubos en las células endoteliales cultivadas y previenen las anomalías de la vascularización placentaria en ratones con microbiota deficiente. Además, en un modelo de desnutrición maternal, la suplementación gestacional con AGCC previene la restricción del crecimiento placentario y la insuficiencia venosa. Estos resultados destacan la importancia de las simbiosis anfitriónmicrobio durante el embarazo y revelan que el microbioma intestinal materno favorece el crecimiento y la vascularización de la placenta en ratones.
¿Qué se sabe ya sobre este tema?
Estudios recientes ponen de relieve la influencia notable del microbioma materno en el desarrollo de la descendencia desde el periodo prenatal 2, pero aún no se sabe exactamente cómo influye el microbioma materno en la salud materno-fetal durante el embarazo. Justo en la intersección entre madre y feto se encuentra la placenta, altamente vascularizada, que permite los intercambios materno-fetales de nutrientes y gases necesarios para el desarrollo del feto 3. Los autores han examinado los efectos del microbioma intestinal materno en el desarrollo de la placenta en ratones, un órgano clave que determina las trayectorias de salud a largo plazo.
¿Cuáles son los principales resultados aportados por este estudio?
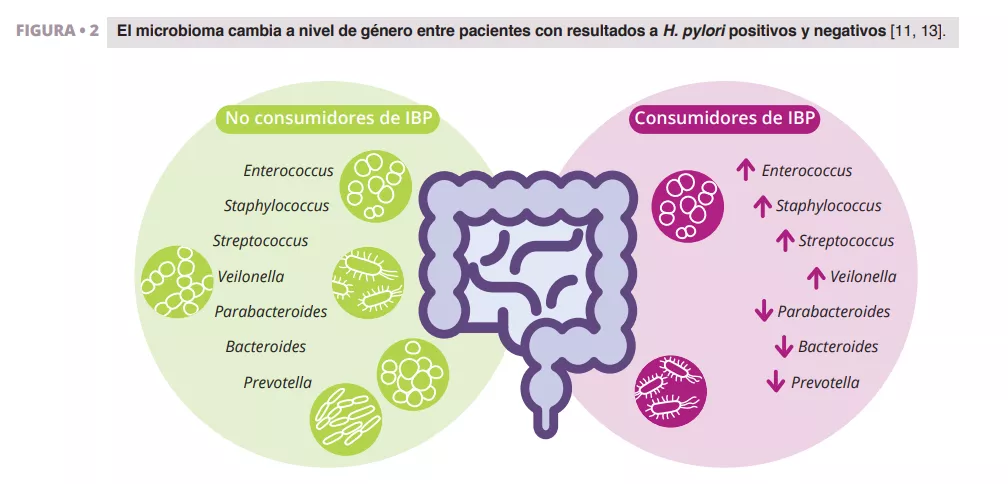
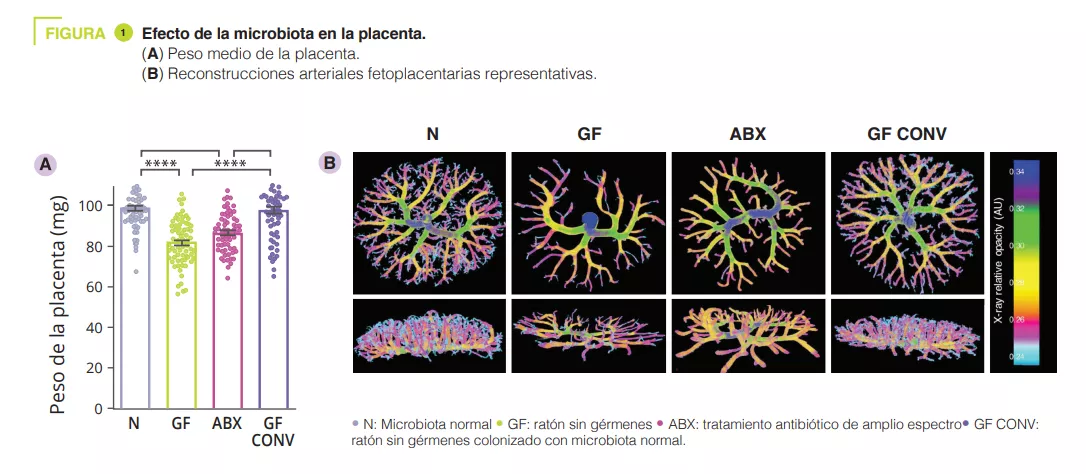
Para determinar los efectos del microbioma intestinal materno en el desarrollo de la placenta, en primer lugar, los autores empobrecieron el microbioma intestinal con antibióticos de amplio espectro (ABX) o criaron ratones hembra sin gérmenes preñadas (GF). El empobrecimiento o la ausencia del microbioma intestinal materno provocó una reducción del peso de la placenta en comparación con ratones con microbiota convencional y con testigos GF colonizados con microbiota convencional, CONV) (figura 1). En consonancia con la reducción del peso de la placenta, el deterioro del microbioma materno provocó a su vez una reducción en el volumen total de la placenta, así como una reducción en el volumen y la densidad de los tejidos en el laberinto placentario, el principal lugar de intercambio materno-fetal. Además de la fisiopatología placentaria inducida por el ABX en la madre, hemos observado reducciones consecuentes del peso y del volumen del feto. La vascularización fetoplacentaria de las madres con deficiencias en la microbiota presentaba un volumen y una superficie vascular reducidos, con disminuciones visibles de las ramas vasculares, en comparación con los testigos sanos (figura 1).
Esto sugiere que el microbioma materno dirige el desarrollo vascular en momentos decisivos de la gestación. Como el microbioma materno regula gran cantidad de metabolitos circulantes, los autores plantearon la hipótesis de que las deficiencias en la vascularización fetoplacentaria podrían estar relacionadas con la microbiota y ser el resultado de alteraciones en metabolitos clave en la circulación fetal. Los autores se centraron en concreto en el papel de los ácidos grasos de cadena corta (AGCC). Los AGCC se producen por la fermentación bacteriana de carbohidratos, y se reducen significativamente en el plasma materno y fetal de madres con deficiencias en la microbiota.
Basándose en investigaciones previas que demostraban que la suplementación materna con AGCC conduce a una transferencia directa de los AGCC de la circulación materna a la circulación fetal, los autores trataron a las madres ABX con agua suplementada con AGCC o con agua de control. Esta estrategia de suplementación aumentaba de manera significativa las concentraciones de butirato y de propionato en la sangre total del feto. El tratamiento de la madre con AGCC aumentó el peso de la placenta y corrigió las alteraciones de crecimiento de la placenta en las madres ABX hasta niveles comparables con los testigos, con los correspondientes aumentos del volumen total de la placenta y del laberinto. A continuación, se trataron células endoteliales de la vena umbilical humana (HUVEC) con AGCC en concentraciones fisiológicas. Los AGCC acetato y propionato aumentaban de manera significativa la longitud de las ramificaciones de las HUVEC en comparación con los testigos vehículo, mientras que la señal con el butirato era menos clara. Este efecto dependía de los receptores de AGCC, FFAR2 y FFAR3 (free fatty acid receptor 2 and 3). En el contexto de una desnutrición materna inducida por una restricción proteica, la suplementación materna con AGCC era suficiente para restaurar el peso y el volumen total de la placenta y aumentar la vascularización fetoplacentaria.
¿Cuáles son las consecuencias en la práctica?
Este estudio demuestra el papel que desempeña la microbiota intestinal materna en la fisiología, y particularmente en la vascularización de la placenta. Las insuficiencias vasculares de la placenta se asocian a la reducción del peso fetal, a la preeclampsia y, en la edad adulta, a un mayor riesgo de numerosas patologías. Las intervenciones centradas en la microbiota, como primer tratamiento nutricional, para favorecer la producción de AGCC podrían desempeñar un papel protector.
- En conjunto, estos datos ponen de relieve el papel clave que desempeña el microbioma intestinal materno en la promoción del crecimiento y del desarrollo de la placenta
- El microbioma materno es necesario para el buen desarrollo de la vascularización fetoplacentaria
- Los AGCC favorecen el crecimiento de la placenta y el desarrollo vascular, incluso en condiciones de desnutrición materna
CONCLUSIÓN
Este estudio pone de relieve que las funciones metabólicas que aporta el microbioma intestinal materno durante el embarazo son parte integrante del apoyo al crecimiento y la vascularización de la placenta en ratones. Una mejor comprensión de la manera en que el microbioma intestinal materno afecta a la estructura y al funcionamiento de la placenta podría permitir el desarrollo de nuevos abordajes para favorecer la salud materna y fetal y reducir el riesgo de enfermedades crónicas.