Análisis longitudinal del microbioma intestinal de adolescentes con anorexia nerviosa: factores relacionados con el microbioma asociados a la evolución clínica
ARTÍCULO COMENTADO Niño
Por el Pr. Emmanuel Mas
Gastroenterología y nutrición, Hospital de Niños, Toulouse, Francia

Comentario del artículo original de Andreani et al. [1]
La función de la microbiota intestinal en la anorexia nerviosa (AN) se confirma cada vez más. Hay estudios que describen que los pacientes que padecen anorexia nerviosa presentan una disbiosis en comparación con testigos sanos. Sin embargo, aún se desconocen los mecanismos subyacentes y los datos sobre los factores que influyen y la evolución longitudinal de los cambios en el microbioma son escasos. En este artículo, los autores presentan datos longitudinales de 57 adolescentes hospitalizados con diagnóstico de anorexia en nueve momentos diferentes (incluido un reconocimiento de seguimiento al año) y los comparan con seis momentos diferentes en 34 testigos sanos. Este estudio ha permitido llegar a la conclusión de que la caracterización de los taxones que revisten interés para el pronóstico podría ser útil para estratificar a los pacientes en el momento del ingreso y, posiblemente, identificar taxones candidatos para futuros estudios de suplementación destinados a mejorar el tratamiento de la anorexia nerviosa.
¿Qué se sabe ya sobre este tema?
La anorexia nerviosa (AN) es un trastorno psiquiátrico muy frecuente en la adolescencia, con una alta mortalidad. Se caracteriza por dismorfofobia, ingesta calórica reducida y desnutrición. Si bien se desconoce la fisiopatología de la AN, el microbioma intestinal (MI) desempeña un papel importante. El MI interviene en el eje intestino-cerebro, tanto con desnutrición como con sobrepeso, y se ve modificado por la alimentación.
El objetivo de este trabajo era estudiar las variaciones del MI a lo largo del tiempo en pacientes con AN. El estudio se llevó a cabo durante un año, durante la hospitalización de los pacientes y hasta el regreso al domicilio, con una evaluación de los parámetros clínicos asociados al MI en la AN.
¿Cuáles son los principales resultados aportados por este estudio?
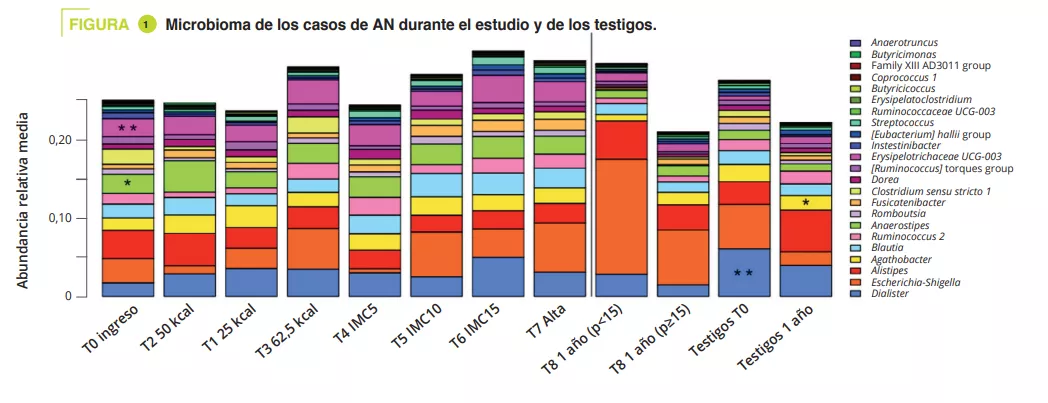
• Se trata del primer estudio longitudinal sobre las modificaciones de la microbiota intestinal en pacientes con AN, realizado durante un período tan prolongado (un año). Se incluyeron 56 pacientes de 12 a 20 años con AN y 34 testigos. Se recogieron muestras de heces desde el momento del ingreso y hasta el alta hospitalaria (T0-T7) y un año después del ingreso (T8). Ocho pacientes volvieron a ser hospitalizados en el transcurso del estudio; se separó a los pacientes que se habían recuperado (IMC ≥ 15o p) y los que seguían teniendo un peso reducido (IMC < 15o p).
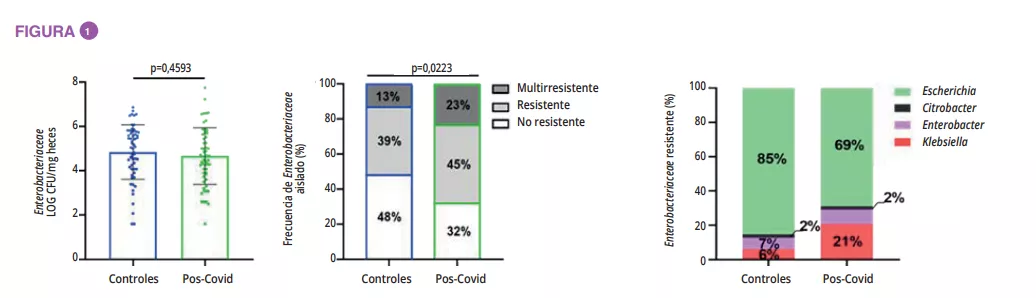
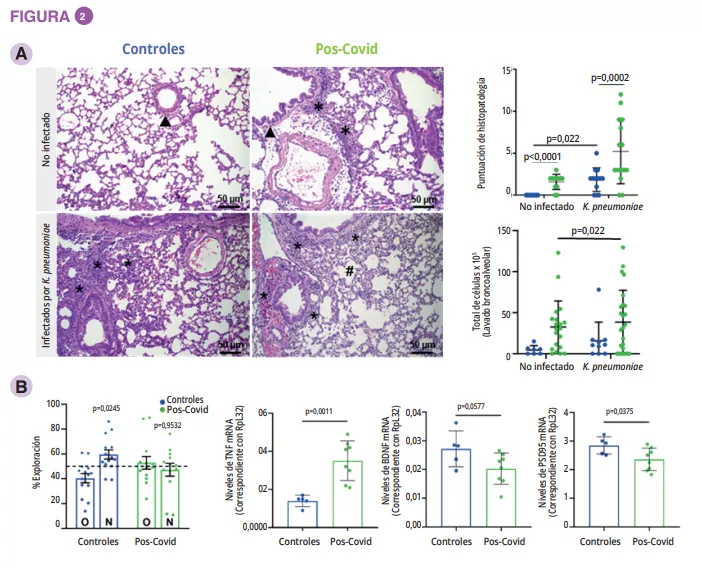
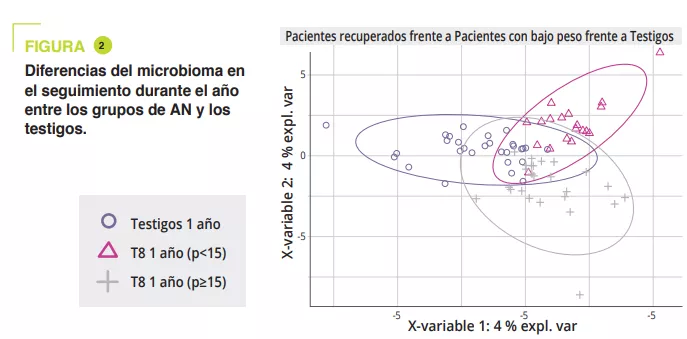
La composición del MI era significativamente diferente en el momento del ingreso durante la fase aguda de desnutrición, sin diferencia en términos de diversidad alfa (figura 1). Las diferencias del MI entre los pacientes con AN y los testigos, aunque eran mínimas, se mantuvieron a lo largo de todo el estudio. En los adolescentes con un IMC < 15o p al año, la diversidad alfa (índice Chao1) se redujo significativamente durante la hospitalización en comparación con el ingreso, la salida y el seguimiento al año. Se observó una tendencia similar en los casos con AN que recuperaron un IMC ≥ 15 respecto de los testigos. En el momento del ingreso, el análisis PERMANOVA mostró una reducción significativa de los géneros Legionella, Dialister, Ruminococcaceae UCG-003 y Limnobacter en comparación con los testigos. Durante el tratamiento en el hospital, las diferencias entre AN y testigos se redujeron, y se mantuvieron solo para las variantes de secuencias amplificadas (ASV). Al año, había diferencias significativas entre los casos de AN con un IMC < 15o p y los testigos en cuanto a los filos, clases y órdenes (p = 0,001 a < 0,001), mientras que eran menores entre los casos de AN con un IMC ≥ 15o py los testigos (p = 0,063 a nivel de ASV) (figura 2).
Entre el ingreso y el seguimiento al año, los casos de AN con un IMC <15o p presentaron una reducción significativa de la abundancia relativa de los géneros Anaerostipes, Clostridium sensu stricto 1 y Romboustia (p = 0,02), mientras que, sorprendentemente, el MI de los casos AN que recuperaron un IMC ≥ 15o p se mantuvo más similar durante el seguimiento. Lo mismo ocurrió con los cambios en el MI entre el alta hospitalaria y el seguimiento al año: una abundancia cuatro veces superior del género Escherichia-Shigella (p = 0,04) y dos veces superior en el caso de Alistipes (p = 0,03) en los casos de AN con un IMC <15o p.
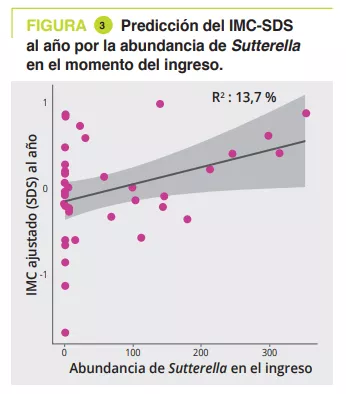
El análisis del MI en el momento del ingreso demostró una asociación significativa entre la duración de la enfermedad (a nivel de filo a familia, p = 0,011 a 0,022) y la cantidad de pérdida de peso (nivel de clase a género, p = 0,030 a 0,047). El análisis longitudinal PERMANOVA, con corrección por la toma de laxantes, mostró una asociación significativa entre el MI y la ingesta calórica (p = 0,003,R2 = 0,009), el IMC-SDS (p = 0,006, R2= 0,008) y la leptina medida al ingreso, al alta hospitalaria y al año (p = 0,02, R2 = 0,02). Los géneros Ruminiclostridium 5 (p = 0,006) e Intestinibacter (p = 0,03) se asociaron con el riesgo de rehospitalización. Un modelo de análisis lineal, corregido por la toma de laxantes, la duración de la enfermedad, la pérdida de peso y el IMC-SDS al ingreso, mostró que había 4 géneros en el momento del ingreso asociados con el IMC-SDS en el seguimiento al año: Sutterella, Parasutturella, Lachnospiraceae FCS020 group y Clostridium stricto sensu (p = 0,008 a 0,04) (figura 3).
¿Cuáles son las consecuencias en la práctica?
Existe una disbiosis en la fase aguda de la AN que mejora en parte gracias al abordaje. La composición del MI en el momento del ingreso puede ayudar a predecir el riesgo de recaída durante el primer año y de mejora del IMC al año. Por ello, es posible que el análisis del MI en el momento del ingreso pueda ayudar a identificar los géneros y taxones Parasutturella, Lachnospiraceae FCS020 group, Clostridium stricto sensu y Alistipes no cultivadas como factores de mal pronóstico. Como una mayor abundancia de Sutterella fue un indicador de evolución favorable, podría ser un objetivo como probiótico.
- El análisis del MI es interesante en adolescentes con AN.
- Se piensa que ciertos microbios pueden ser factores de riesgo de evolución desfavorable, mientras que Sutterella podría ser beneficiosa y un objetivo como probiótico.
CONCLUSIÓN
Este estudio demostró que la composición del MI está asociada a la duración de la AN y a la pérdida de peso en el momento del ingreso, pero también que en la evolución del MI durante el abordaje de la enfermedad influyen las calorías ingeridas, el aumento de peso y la leptina.