La dispepsia funcional
La dispepsia funcional es un trastorno digestivo tan frecuente como extraño su nombre. Dolor o ardor de estómago, sensación de estómago demasiado lleno, malestar, náuseas… son sus síntomas característicos. Aunque la dispepsia funcional no compromete el pronóstico vital, altera la calidad de vida a través de un mecanismo en el que la microbiota intestinal parece estar implicada. Para aliviar los síntomas, se puede adaptar la alimentación. Otra pista: modular la microbiota intestinal con probióticos.

¿Qué es la dispepsia funcional?
Síntomas y prevalencia
Este nombre no le suena familiar al público general. Sin embargo, la dispepsia funcional (DF) es un trastorno gastrointestinal muy frecuente que, a la fecha, todavía no se entiende muy bien y está infradiagnosticado. La DF genera por sí sola del 3 al 5% de las consultas al médico en América del Norte 1 !
El término “dispepsia” procede del griego dys (malo) y pepsis (digestión).
Los síntomas de la DF son muy variados y se asocian siempre a la sensación de digerir mal 2:
- saciedad precoz cuando falta mucho para terminar la comida,
- sensación de haber comido demasiado (estómago que parece pesado y distendido), a pesar de una comida perfectamente razonable
- dolor o ardor en la parte alta del estómago
- falta de apetito
- eructos o hipo
- náuseas e incluso vómitos
¡Advertencia!
Para que se pueda establecer el diagnóstico de DF, los síntomas deben ser duraderos: al menos 6 meses de duración con al menos 3 meses consecutivos.
Cabe distinguir 2 tipos de dispepsia funcional:
- el síndrome de distrés posprandial, caracterizado por una sensación de estómago distendido (plenitud posprandial) después de la comida o de saciedad precoz incluso antes de terminar de comer
- el síndrome de dolor epigástrico, con síntomas que carecen de relación directa con la comida (ardor de estómago, etc.)
¿Lo sabía?
La dispepsia se llama “funcional” porque no se acompaña de ninguna anomalía estructural de los órganos y tejidos digestivos. Los síntomas experimentados no pueden explicarse por la presencia de una lesión gástrica (ausencia de úlcera), ni por ninguna otra anomalía orgánica o estructural, y todos los exámenes realizados (gastroenteroscopia, ecografía, tomografía computarizada…) producen resultados negativos.
¿A cuántas personas afecta esta enfermedad? ¿Cuáles son las personas de alto riesgo?
Según los estudios, se estima que la DF afecta a entre el 10 y el 30% de los adultos y entre el 3 y el 27% de los niños en el mundo 2. Las mujeres, los fumadores y las personas que toman antiinflamatorios no esteroideos (ibuprofeno, ketoprofeno) están expuestos a un mayor riesgo 3.
7% de los adultos están afectados por dispepsia funcional ⁴
del 3 al 27% de los niños en el mundo están afectados por dispepsia funcional ⁴
Las consecuencias para los pacientes no son ni mucho menos despreciables: dos de cada tres personas afectadas por la DF padecen síntomas persistentes e irregulares que pueden mermar su calidad de vida y su bienestar 1.

¿Cuáles son los factores asociados a la dispepsia funcional?
Estilo de vida, alimentación...
La alimentación
Se reconoce cada vez más que la alimentación desempeña un papel en el desencadenamiento de los síntomas de dispepsia funcional. ¿Los culpables? Ante todo, los alimentos grasos. Pero no son los únicos. Otros alimentos, como los que contienen glúcidos, la leche y los productos lácteos, los cítricos, los alimentos muy condimentados, el café y el alcoholtambién están implicados 5. Sin embargo, hay un problema: los resultados son poco coherentes.
¿Qué alimentos se asocian a qué síntomas?
- Sensación de plenitud excesiva después de la comida: carne roja, plátano, pan, trigo, tartas, pasta, salchichas, alimentos fritos, alubias, mayonesa, leche, chocolate, huevos, caramelos, naranja y otros cítricos
- Eructos: bebidas con gas, cebolla, alubias, leche y plátano
- Ardor en la parte alta del estómago: café, queso, cebolla, pimienta, leche, chocolate, piña 5
La mente también podría intervenir en la ecuación, ya que el recuerdo de una mala experiencia puede conducir a los pacientes a anticipar síntomas y a sentirlos en exceso en caso de reexposición. La experiencia demuestra que basta con distraer a un paciente con una tarea cognitiva para que olvide los síntomas; a la inversa, mentir sobre el porcentaje de grasa de un yogur (anunciando un porcentaje superior a la realidad) aumenta las náuseas que siente el paciente.
FODMAP y dispepsia
Los FODMAP (Fermentable Oligo, Di-, Mono-mers and Polyols) son glúcidos que el ser humano no es capaz de digerir. Por lo tanto, son fermentados por las bacterias intestinales (sobre todo por las bifidobacterias) y producen gas (y, por lo tanto, hinchazón). Se han descrito otros efectos potenciales, como el aumento del volumen de agua del contenido digestivo y una producción excesiva de (sidenote: Ácidos Grasos de Cadena Corta (AGCC) Los Ácidos Grasos de Cadena Corta (AGCC) son una fuente de energía (carburante) de las células de la persona que interactúan con el sistema inmunitario y están implicadas en la comunicación entre el intestino y el cerebro. Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) (propionato, butirato y acetato). Según ensayos clínicos recientes, los FODMAP podrían estar implicados en la patogenia de la dispepsia 6.
El estrés y la ansiedad
Los pacientes con DF a menudo están estresados y ansiosos: un estudio a gran escala demostró que la ansiedad estaba claramente relacionada con la enfermedad, en concreto con el distrés posprandial; otro estudio en el que participaron 18 000 japoneses mostró que los pacientes con síntomas de DF se sienten más estresados en la vida cotidiana, señalan con mayor frecuencia que no duermen lo suficiente y se quejan más de dificultades para conciliar el sueño 5.
La falta de actividad física
Los pacientes con DF suelen tener menos actividad física. Y es una lástima porque parece ser que el deporte puede reducir los síntomas y mejorar el tránsito y la evacuación de los gases en las personas que padecen hinchazón 5.
Microbiota y deporte: microorganismos competitivos
El tabaco
Un estudio realizado con 2560 sujetos suecos reveló que los fumadores están más expuestos al síndrome de distrés posprandial: fumar 10 a 19 cigarrillos al día aumenta un 42% el riesgo, mientras que si se fuma más de una cajetilla al día. este riesgo aumenta a más del doble 7.
La obesidad
La obesidad se asocia a numerosos síntomas gastrointestinales, incluida la DF. Se han formulado varias hipótesis: por ejemplo, en las personas obesas, los receptores orales e intestinales encargados de alertar al organismo de la presencia de grasas podrían estar alterados, lo que amplificaría los efectos gastrointestinales en estos pacientes y los haría más sensibles a las grasas alimentarias 5.
Por otra parte, algunos especialistas hablan de una relación recíproca entre la DF y el (sidenote: Síndrome metabólico El síndrome metabólico, también llamado síndrome X, se caracteriza por la combinación de varios trastornos metabólicos en un mismo sujeto, entre ellos un perímetro de cintura elevado (debido a un exceso de tejido adiposo abdominal), hipertensión, glucemia en ayunas anormal o resistencia a la insulina y dislipidemia. ) , de modo que uno favorecería al otro y viceversa, generando un círculo vicioso 1.
La bacteria Helicobacter pylori
Desde la década de 1980 se sabe que el estómago, a pesar de su alto grado de acidez, no es estéril sino que alberga una comunidad de microorganismos que incluye la bacteria H. pylori. La infección por H. pylori parece causar la aparición y la progresión de la DF: los pacientes que tienen antecedentes de infección por H. pylori presentan un riesgo más elevado de desarrollar DF 2.

¿Cuál es el papel de la microbiota?
Disbiosis, papel de los metabolitos microbianos...
Disbiosis generalizada a todo lo largo del aparato digestivo
El tubo digestivo alberga cerca de 100 000 millones de microorganismos, que pertenecen a más de 1000 especies: la microbiota gastrointestinal.
Proteobacterias, Firmicutes, actinobacterias y Bacteroidetes dominan ampliamente esta comunidad ya que representan más del 98% de la microbiota intestinal, con un predominio de Firmicutes, seguidos de actinobacterias y Bacteroidetes 2. Esto al menos en las personas sanas. En cambio, no existe este equilibrio en las personas que padecen ciertas enfermedades como la DF: se observa una disbiosis en todo el aparato digestivo, desde la boca hasta el ano 2.
Por ejemplo, en estudios realizados en pacientes con DF se hicieron las siguientes observaciones:
- mayor abundancia de Firmicutes, estreptococos (asociados a síntomas en la parte alta del estómago), Bifidobacterium y Clostridium
- menor abundancia de Prevotella (asociada a más síntomas de malestar después de comer)
¿Ha oído hablar alguna vez de “disbiosis”?
Papel de los metabolitos microbianos
El papel de la microbiota en la DF no se limita ni mucho menos a las bacterias presentes. De hecho, cada una de estas bacterias segrega diversas moléculas activas, beneficiosas o nocivas, estrechamente relacionadas con la salud del huésped y con la aparición y progresión de numerosas enfermedades 2,3. Por ejemplo:
- ciertos metabolitos bacterianos ejercen efectos beneficiosos (por ejemplo, los (sidenote: Ácidos Grasos de Cadena Corta (AGCC) Los Ácidos Grasos de Cadena Corta (AGCC) son una fuente de energía (carburante) de las células de la persona que interactúan con el sistema inmunitario y están implicadas en la comunicación entre el intestino y el cerebro. Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) producidos por Firmicutes)
- otros ejercen efectos perjudiciales para el huésped (esfingolípidos proinflamatorios producidos por Bacteroidetes y Prevotellaceae) 3
¿Cuáles con los mecanismos implicados?
La inmunidad, el eje intestino-cerebro...
Los investigadores, que por el momento solo tienen conocimientos parciales, consideran que los mecanismos que conducen a la DF probablemente son multifactoriales y variables de un paciente a otro 8. Varios mecanismos están implicados en la DF:
Alteración de la barrera intestinal
Normalmente, los alimentos que transitan por el aparato digestivo permanecen aislados del organismo por una barrera: la mucosa intestinal. Esta barrera es semipermeable ya que permite la absorción de nutrientes pero impide el paso a sustancias nocivas y patógenos diversos y variados que se ingieren al mismo tiempo que la comida 2.
En los pacientes con DF, la integridad de esta mucosa está alterada, de manera que no desempeña a la perfección su función de filtro.
Alteración de la inmunidad intestinal
En los pacientes con DF, se observa aparentemente una sobreactivación de la respuesta inmunitaria: el 40% de los pacientes presentan infiltrados de células inflamatorias en el duodeno y se observa a menudo una proliferación de bacterias (en especial bacterias orales) 9 en el intestino delgado, lo que podría activar esta respuesta inmunitaria.Por otra parte, algunos investigadores piensan que conviene centrarse en la microbiota del (sidenote: Intestino delgado Pparte del aparato digestivo situada entre el estómago y el intestino grueso (o colon), esencial para la digestión y la absorción de nutrientes. Tiene una longitud de 6,5 a 7 m, siendo la porción más larga del tubo digestivo, y comprende el duodeno, el yeyuno y, por último, el íleon. ) para comprender mejor la patogenia de la DF 9.
La proliferación de bacterias en el intestino delgado (o SIBO, acrónimo de small intestinal bacterial overgrowth) podría desempeñar un papel en la patogenia de la DF; esta proliferación parece más frecuente en los pacientes con DF que en los pacientes que no presentan estos síntomas 10,11. Entre los pacientes con DF, los que recibieron IBP (inhibidores de la bomba de protones, medicamentos utilizados para reducir la secreción de ácido gástrico) parecen estar expuestos a un mayor riesgo de SIBO 12. Al reducir la acidez del estómago, los IBP merman esta barrera química que supuestamente destruye, gracias al ácido clorhídrico segregado por las paredes del estómago, numerosos microorganismos patógenos. Esto podría explicar la presencia de un exceso de bacterias en el intestino delgado, situado justo después del estómago.
No obstante, las pruebas de una relación entre la DF y el SIBO siguen siendo escasas; debido a las dificultades para tomar muestras de la microbiota duodenal, los estudios se basan, en general, en la detección de gases contenidos en el aire espirado por los pacientes. Esta prueba es fácil de realizar y no es invasiva, pero adolece de una innegable falta de fiabilidad 11.
Desregulación del eje intestino-cerebro
Existen interacciones complejas entre la microbiota intestinal, el aparato digestivo y el sistema nervioso central. Este eje microbiota-intestino-cerebro explica que el estrés pueda producir dolor de barriga o que las modificaciones de la microbiota intestinal puedan alterar la motilidad intestinal e «informar» al cerebro, que a su vez puede regular el intestino. Ahora bien, la DF está estrechamente relacionada con trastornos de la motilidad gastrointestinal (puesto que esta depende del control cerebral) y con la hipersensibilidad gastrointestinal, que a su vez están vinculados con la microbiota gastrointestinal 2. De ahí a pensar que todo está relacionado no hay más que un paso…
El eje intestino-cerebro: ¿Cuál es el papel de la microbiota?
Respuesta anormal a la ingesta de alimentos
La presencia de nutrientes en la luz del tubo digestivo genera señales que adaptan la digestión: por ejemplo, una comida rica en grasas se queda más tiempo en el estómago, provocando un retraso del vaciado gástrico. En los pacientes con DF, la ingesta de alimentos podría asociarse a señales exageradas procedentes del tracto gastrointestinal. Esto produciría una serie de síntomas sin relación con la realidad: sensación de saciedad cuando la comida acaba de empezar, hipersensibilidad a la distensión gástrica, etc. 5

¿Cuáles son los tratamientos y las perspectivas terapéuticas de la dispepsia funcional?
Alimentación, probióticos...
Alimentación
Dado que se sospecha que la alimentación participa en la DF, su adaptación podría, lógicamente, mejorar los síntomas. Sin embargo, faltan estudios que demuestren los efectos de dietas específicas. Aun así, los expertos consideran que una gran parte de los pacientes deberían beneficiarse de una dieta menos rica en grasas y de una alimentación fraccionada (comidas más pequeñas y más frecuentes). De hecho, en la práctica es lo que ya sucede: los pacientes con DF tienen un aporte de grasas alimentarias ligeramente reducido y tienden a tomar comidas más pequeñas con mayor frecuencia 5.
Otros pacientes podrían beneficiarse de eliminar de su dieta los alimentos condimentados o ácidos (tomate, cítricos, etc.) o los alimentos ricos en fibras o FODMAP, que producen hinchazón. Sin embargo, estos cambios deben introducirse con prudencia para no desequilibrar la dieta 2.
La alimentación
Inhibidores de la bomba de protones
Los inhibidores de la bomba de protones (IBP) son medicamentos utilizados para reducir la secreción de ácido gástrico. Los médicos los prescriben para el tratamiento del reflujo gastroesofágico y la úlcera gastroduodenal.
A corto plazo, los inhibidores de la bomba de protones (IBP) pueden mejorar los síntomas de la DF, pero su uso prolongado parece asociarse a un aumento de estreptococos y, por lo tanto, a una disbiosis perjudicial 13.
Antibióticos para erradicar H. pylori
Según el American College of Gastroenterology y la Asociación Canadiense de Gastroenterología, los pacientes con DF menores de 60 años deberían someterse primero a una prueba de detección de H. pylori. Si dan positivo, se les debe proponer antibiótico para erradicar la bacteria.
Sin embargo, esta estrategia tiene limitaciones; solo 1 de cada 10 pacientes experimenta una mejoría de los síntomas, mientras que estos empeoran en los demás sujetos 14.
Antibióticos: ¿qué impacto en la microbiota y en nuestra salud?
Probióticos
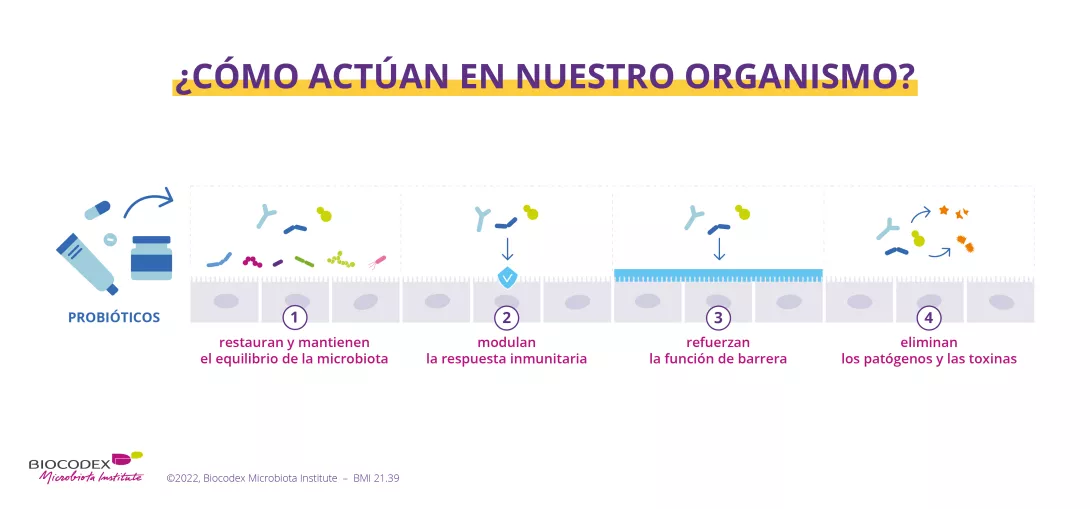
Dado que la disbiosis gastrointestinal está estrechamente relacionada con la aparición y la progresión de la DF, resulta lógico considerar la regulación de la microbiota gastrointestinal como un tratamiento potencial 2. El papel de los probióticos podría ser multifactorial 15 :
- restauración de la microbiota comensal eliminada por los patógenos
- restauración de la permeabilidad de la barrera intestinal
- reducción de la hipersensibilidad visceral
- efectos antiinflamatorios locales y sistémicos
- regulación de la motilidad intestinal
Todos estos efectos beneficiosos podrían atenuar los síntomas de DF 15.
Una gran cantidad de ensayos clínicos parecen confirmar «en la práctica» que los probióticos son capaces de mejorar los síntomas de los pacientes 2,15 .
Sin embargo, los resultados publicados en los últimos 15 años no bastan para llegar a una conclusión porque los estudios tienen defectos: la definición de la enfermedad ha cambiado; los estudios confunden a menudo DF (prolongada) e infección por H. pylori (de corta duración); los probióticos utilizados varían ampliamente de un estudio a otro; las declaraciones de los síntomas experimentados por los pacientes son poco fiables debido a la ausencia de evaluación clínica objetiva 15. Es necesario llevar a cabo estudios complementarios.
Terapias alternativas
Ciertas terapias alternativas se reconocen como tratamientos seguros y eficaces para la DF:
- la terapia cognitiva comportamental, a menudo utilizada en caso de estrés y ansiedad, ayuda al paciente a identificar los pensamientos o comportamientos que producen o exacerban la expresión de síntomas
- la hipnoterapia, durante la cual el paciente, en estado de hipnosis, es más receptivo a las sugerencias terapéuticas
- También se está estudiando el potencial de la realidad virtual 14.
La microbiota intestinal
 Dispepsia funcional: un nombre complicado para un trastorno digestivo común
Dispepsia funcional: un nombre complicado para un trastorno digestivo común
 Trastornos intestinales funcionales: síntomas digestivos
Trastornos intestinales funcionales: síntomas digestivos