Jaka jest różnica między prebiotykami, probiotykami i postbiotykami?
Prebiotyki, probiotyki, postbiotyki… Za tymi mylącymi terminami kryje się w rzeczywistości ekscytujący wszechświat związany z naszym zdrowiem. Te „biotyki” dyskretnie przyczyniają się do poprawnego funkcjonowania naszej mikrobioty jelitowej. Gotowi dowiedzieć się więcej na temat ich wyjątkowych ról i fundamentalnych różnic? W tym artykule rozwikłamy tajemnice tej mikroskopijnej sieci. Zgłębcie razem z nami kwestię nieoczekiwanych sprzymierzeńców dobrego samopoczucia. Odkryjmy razem ten fascynujący ekosystem, który znajduje się w każdym z nas!
Introduction
Za chwilę zagłębimy się w fascynujący świat „biotyków”. Być może zastanawiacie się teraz: „Czym właściwie są te biotyki?” Wszystko sprowadza się do starożytnego greckiego słowa „bíos”, które oznacza po prostu „życie”. Od tego słowa pochodzą takie terminy jak probiotyki, prebiotyki, postbiotyki, synbiotyki. Nie są to tylko wymyślne nazwy naukowe – są jak różne części składające się na tętniącą życiem okolicę, z których każda odgrywa wyjątkową rolę w utrzymaniu płynnego działania.
Wyobraź sobie, że jesteś nowym mieszkańcem bloku, a przyjazny sąsiad oferuje ci oprowadzenie po okolicy, wskazując wszystkie najważniejsze osoby i miejsca, które ułatwiają odpowiednie funkcjonowanie społeczności. Właśnie to tutaj robimy – oprowadzamy lokalną wycieczkę po „biotycznym” sąsiedztwie wewnątrz twojego ciała.

Probiotyki: pomocnicy twojego ciała
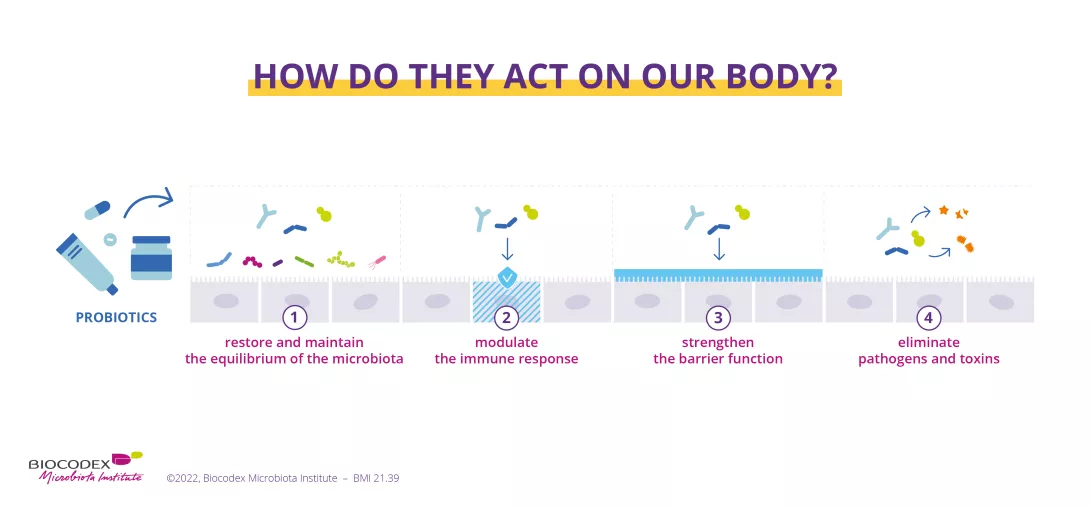
W naszym mieście zdrowia probiotyki są jak odwiedzający nas pożyteczni przyjaciele – żywe mikroorganizmy które mieszkają w nas i przyczyniają się do naszego dobrego samopoczucia. Zgodnie z definicją Światowej Organizacji Zdrowia (WHO) i Międzynarodowego Towarzystwa Naukowego ds. Probiotyków i Prebiotyków (ISAPP), probiotyki to „żywe mikroorganizmy, które podawane w odpowiednich ilościach przynoszą korzyści zdrowotne gospodarzowi”. 1
Mówiąc prościej, są to korzystne mikroby, takie jak bakterie, drożdże itp., które wspierają nasze ogólne samopoczucie. Probiotyki przyczyniają się do naszego zdrowia na różne sposoby:
- promowanie zrównoważonego mikrobiomu 2
- hamowanie wzrostu patogenów wewnątrz ludzkiego ciała 3
- poprawa funkcji barierowych i metabolicznych narządów docelowych 4, 5, 6
- wspieranie funkcji odpornościowych 7
- oraz modulacja różnych szlaków sygnałowych i metabolicznych 8
Jednym z powszechnych nieporozumień jest to, że każdy rodzaj fermentowanej żywności, np. jogurt, kefir lub kombucha, jest z natury probiotyczny. 9 Choć fermentacja może wprowadzać korzystne bakterie, nie wszystkie produkty fermentowane zawierają żywe szczepy probiotyczne, które spełniają kryteria określone przez organy ds. zdrowia. 10 Jednak niektóre sfermentowane produkty spożywcze są fermentowane przy użyciu mikroorganizmów o udowodnionym działaniu probiotycznym lub zostały uzupełnione probiotykami w wystarczających ilościach, aby zapewnić korzyści zdrowotne.
Ważne jest, aby uważnie czytać etykiety i polegać na renomowanych źródłach aby upewnić się, że spożywamy produkty z naukowo i klinicznie potwierdzonymi kulturami probiotycznymi. Ponadto niektórzy zakładają, że probiotyki są uniwersalnym rozwiązaniem, ale różne szczepy mogą mieć odmienny wpływ na poszczególne osoby i warunki zdrowotne. 1, 11 Konsultacje z pracownikami opieki zdrowotnej i przestrzeganie wytycznych opartych na dowodach ma kluczowe znaczenie dla optymalizacji korzyści płynących ze stosowania probiotyków na podstawie wyjątkowych potrzeb i okoliczności.
Jeśli chcesz dowiedzieć się więcej o probiotykach, możesz przeczytać naszą dedykowaną sekcję tutaj:
Probiotyki

Prebiotyki: jedzenie dla dobrych ludzi – ale nie tylko!
Prebiotyk definiuje się jako „substrat, który jest selektywnie wykorzystywany przez mikroorganizmy gospodarza, przynosząc korzyści zdrowotne”. 12, 13 W przeciwieństwie do probiotyków prebiotyki same w sobie nie są żywymi drobnoustrojami, ale raczej służą jako „pożywienie” dla istniejących korzystnych bakterii w naszym mikrobiomie. Opisywanie prebiotyków jako „pożywienia dla probiotyków” jest powszechnym uproszczeniem.
Podczas gdy prebiotyki wspierają wzrost probiotyków, ich korzystne działanie wynika z aktywności rezydentnej mikrobioty jelitowej, która metabolizuje te związki, pośrednio zapewniając gospodarzowi – czyli nam – korzyści fizjologiczne! Co więcej, nie wszystkie błonniki pokarmowe są prebiotykami i nie wszystkie prebiotyki są błonnikami. 14 To rozróżnienie jest często pomijane, co prowadzi do błędnych wyobrażeń na temat ich definicji i funkcji.
Wyobraźcie sobie prebiotyki jako ulubione restauracje dla pomocnych bakterii. Takie pokarmy jak banany, cebula i czosnek są bogate w substancje, np. inulinę i galaktooligosacharydy (GOS), które działają jak prebiotyki. Kiedy pożyteczne bakterie jedzą te pokarmy, mogą zwiększyć produkcję cząsteczek, tj. metabolitów, takich jak krótkołańcuchowe kwasy tłuszczowe (sidenote: Krótkołańcuchowe kwasy tłuszczowe Krótkołańcuchowe kwasy tłuszczowe są źródłem energii (paliwa) dla komórek organizmu, współdziałają z układem odpornościowym i biorą udział w komunikacji między jelitami a mózgiem. Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) octan, propionat i maślan, które z kolei mogą poprawić stan zdrowia. 15
Oprócz wspierania zdrowia jelit prebiotyki zostały powiązane z przywróceniem równowagi mikrobioty w celu lepszej obrony przed patogenami 16, kontroli wagi 17, lepszego wchłaniania minerałów 18, itp. Ich korzyści wykraczają poza same jelita. 19
Przygotowaliśmy również specjalną sekcję poświęconą prebiotykom i korzyściom, jakie zapewniają naszemu zdrowiu:
Prebiotyki: najważniejsze, co trzeba wiedzieć

Postbiotyki: podarunki od mikrobów
Po tym, jak probiotyki zakończą swoją wizytę w mieście, pozostawiają po sobie prezenty znane jako postbiotyki. Są to produkty i usługi, które firmy w mieście dostarczają po przyjęciu surowców. Postbiotyki obejmują korzystne substancje, takie jak witaminy i (sidenote: Krótkołańcuchowe kwasy tłuszczowe Krótkołańcuchowe kwasy tłuszczowe są źródłem energii (paliwa) dla komórek organizmu, współdziałają z układem odpornościowym i biorą udział w komunikacji między jelitami a mózgiem. Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) . Są one nagrodą dla organizmu za ciężką pracę probiotyków.
Definicja ta była wielokrotnie zmieniana, a społeczność naukowa osiągnęła obecnie konsensus: „postbiotyk to preparat z mikroorganizmów nieożywionych i/lub ich składników, który przynosi korzyści zdrowotne gospodarzowi”. . Oznacza to, że postbiotyki to nie tylko „przetworzone” odpady probiotyków (lub ich produkty końcowe), ale także same „martwe” probiotyki oraz ich fragmenty! 20
Wykazano, że postbiotyki (tak jak probiotyki) wzmacniają funkcję bariery, zmniejszają stan zapalny i wykazują działanie przeciwdrobnoustrojowe przeciwko patogenom, polepszając w ten sposób ogólny stan zdrowia. 21 Ich korzystne właściwości wykraczają również poza jelita, przynosząc korzyści dla zdrowia skóry i pochwy oraz potencjalnie zajmując się schorzeniami skóry i pochwy. 22, 23
Mogły obić się wam o uszy dodatkowe nazwy, takie jak parabiotyki, paraprobiotyki lub proteobiotyki, i faktycznie niektórzy badacze próbowali dokładniej zdefiniować różne elementy lub części składnika postbiotycznego, tj. martwe komórki, składniki komórek i metabolity wytwarzane przez te komórki drobnoustrojów.
- Choć parabiotyki i paraprobiotyki są synonimami i są używane do opisania nieaktywnych komórek drobnoustrojów, zarówno nienaruszonych, jak i uszkodzonych, należy o nich myśleć jako o „duchach” tych drobnoustrojów, które wciąż są w stanie pomóc . 24
- Z drugiej strony proteobiotyki są naturalnymi metabolitami wytwarzanymi przez probiotyki podczas fermentacji. 25, 26
Nie ma jednak zgody co do tych możliwych definicji i wszystkie mieszczą się w definicji postbiotyku ISAPP. 20

Synbiotyki, praca zespołowa w działaniu i ciekawy przypadek psychobiotyków
Synbiotyki są jak projekty społecznościowe, które łączą wszystkich na drodze do osiągnięcia wspólnego celu. 27 Łączą one probiotyki i prebiotyki w jednym produkcie, zapewniając dobrym bakteriom nie tylko miejsce do życia, ale także mnóstwo ich ulubionego pożywienia od samego początku. To połączenie można znaleźć w niektórych jogurtach i suplementach diety – powstają one w taki sposób, aby wszystko ze sobą współgrało, zapewniając jeszcze większe korzyści zdrowotne.
Z drugiej strony psychobiotyki to zupełnie nowa kategoria probiotyków i prebiotyków, które mogą faktycznie korzystnie wpływać na zdrowie psychiczne, jeśli są odpowiednio spożywane. 28 Działają one poprzez coś, co nazywa się osią jelitowo-mózgową. Zasadniczo jelita i mózg są fizycznie połączone i stale się ze sobą komunikują. Mikroby żyjące w jelitach mogą wysyłać sygnały do mózgu, które wpływają na nastrój, funkcje poznawcze, a nawet zachowanie.
Naukowcy są naprawdę podekscytowani potencjałem psychobiotyków. Wczesne badania wykazują, że mogą one pomóc w zapobieganiu lub poprawie takich stanów jak choroby neurodegeneracyjne (np. choroba Alzheimera lub Parkinsona). Niektóre dowody sugerują nawet, że psychobiotyki mogą odgrywać rolę terapeutyczną w leczeniu zaburzeń psychicznych, takich jak depresja czy stany lękowe. 29
Możecie dowiedzieć się więcej na temat interakcji między jelitami a mózgiem tutaj:
Oś jelita-mózg: Jaką rolę odgrywa mikrobiota?
A co z antybiotykami?
Konieczne jest także rozróżnienie antybiotyków od innych „biotyków”. Podczas gdy antybiotyki są kluczowymi lekami ratującymi życie w leczeniu infekcji bakteryjnych, ich masowe lub nadmierne stosowanie może poważnie zakłócić delikatną równowagę mikrobiomu, potencjalnie powodując niezamierzone i daleko idące konsekwencje. 30, 31 Te silne leki nie rozróżniają szkodliwych i pożytecznych bakterii, co oznacza, że mogą zdziesiątkować ważne populacje drobnoustrojów, które promują zdrowie i odporność.
Antibiotic resistance
Ponadto nadużywanie antybiotyków przyczynia się do alarmującego wzrostu liczby superbakterii opornych na antybiotyki, co stanowi poważne globalne zagrożenie dla zdrowia. 30 Dlatego konieczne jest rozsądne stosowanie antybiotyków i tylko wtedy, gdy jest to absolutnie konieczne, pod nadzorem pracowników opieki zdrowotnej.
Utrzymanie zdrowego, zróżnicowanego mikrobiomu za pomocą probiotyków, prebiotyków i innych „biotyków” może pomóc przeciwdziałać niektórym szkodom ubocznym spowodowanym przez antybiotyki i wspierać ogólne samopoczucie.
Tutaj można znaleźć specjalną sekcję poświęconą wpływowi antybiotyków na mikrobiotę i zdrowie:
Antybiotyki: jaki wpływ na mikrobiotę i nasze zdrowie?
Każdego roku od 2015 r. WHO organizuje Światowy Tydzień Wiedzy o Antybiotykach (WAAW, ang. World Antibiotic Awareness Week), którego celem jest zwiększanie świadomości dotyczącej globalnej oporności na leki przeciwdrobnoustrojowe.
Oporność na środki przeciwdrobnoustrojowe występuje, gdy bakterie, wirusy, pasożyty i grzyby zmieniają się na przestrzeni czasu i nie odpowiadają już na leki. W rezultacie lekooporności antybiotyki i inne leki przeciwdrobnoustrojowe stają się nieskuteczne, a wyleczenie zakażeń jest coraz trudniejsze lub niemożliwe, co zwiększa ryzyko rozprzestrzeniania się chorób, ich ciężkiego przebiegu oraz zgonu.
Niniejsza kampania, obchodzona w dniach 18–24 listopada, zachęca całe społeczeństwo, fachowy personel medyczny oraz decydentów do ostrożnego stosowania antybiotyków, leków przeciwwirusowych, przeciwgrzybiczych i przeciwpasożytniczych, aby zapobiec dalszemu wyłanianiu się oporności mikroorganizmów.