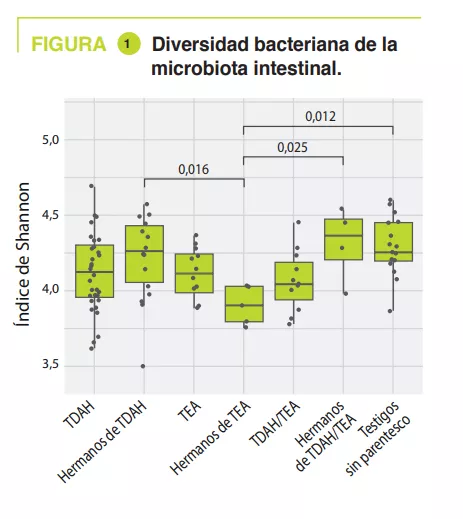
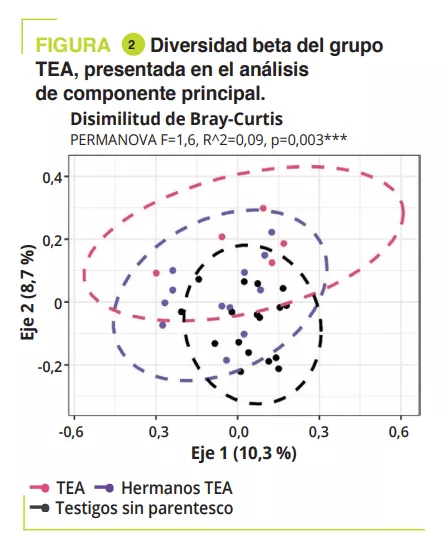
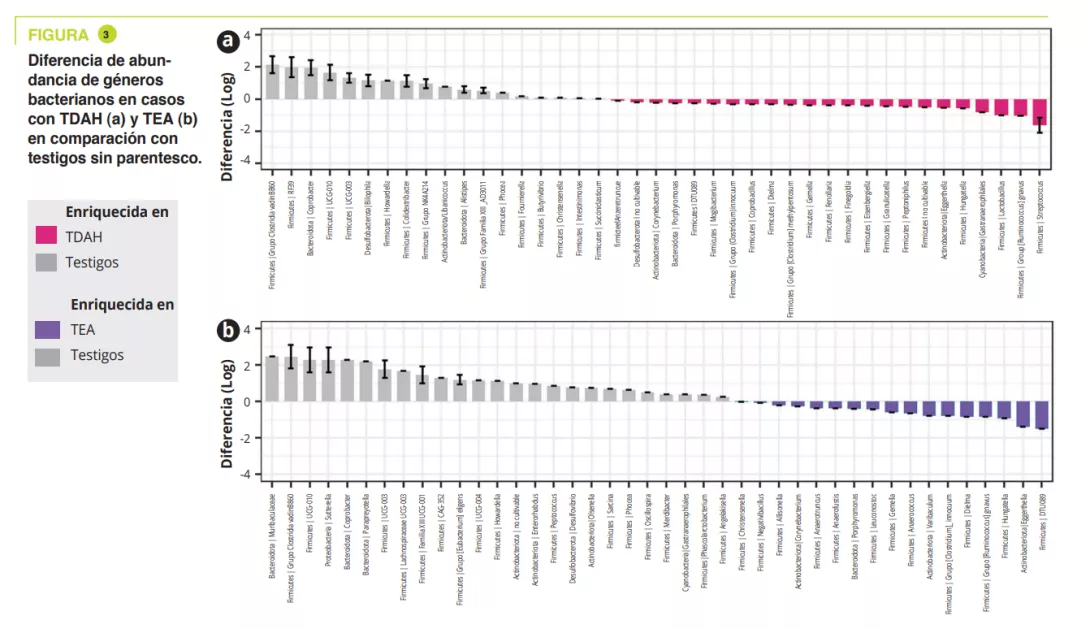
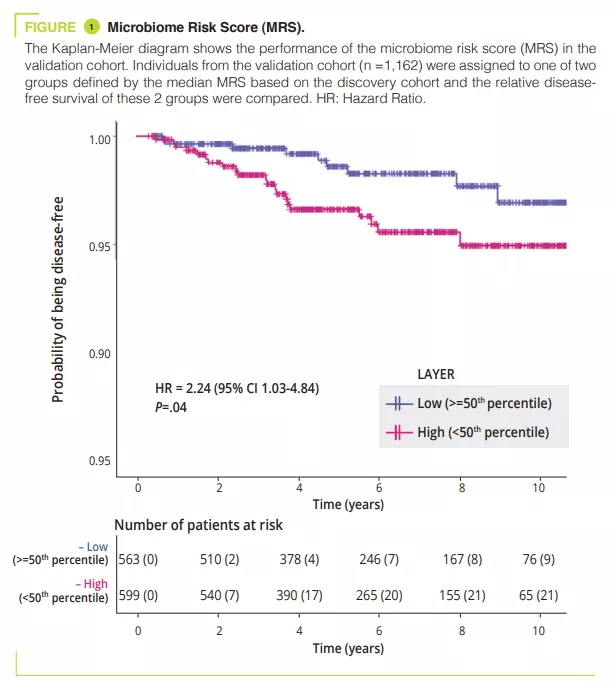
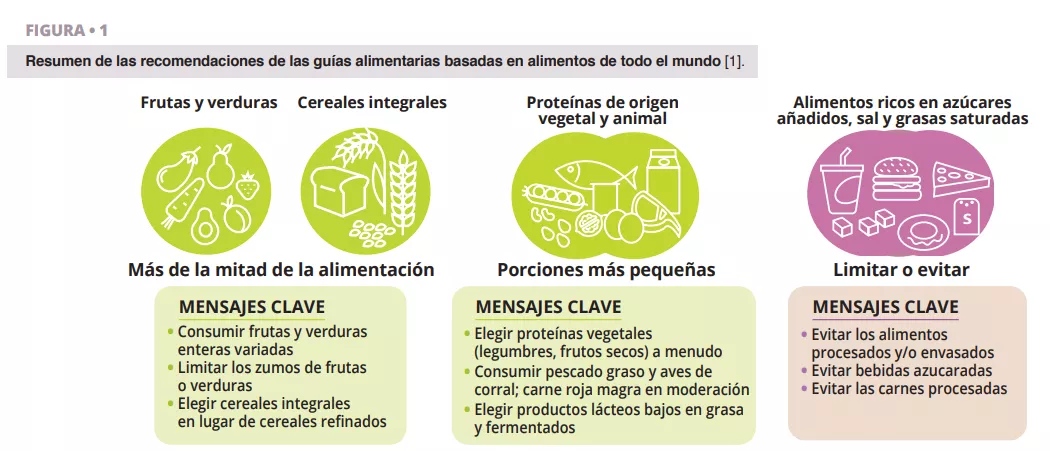
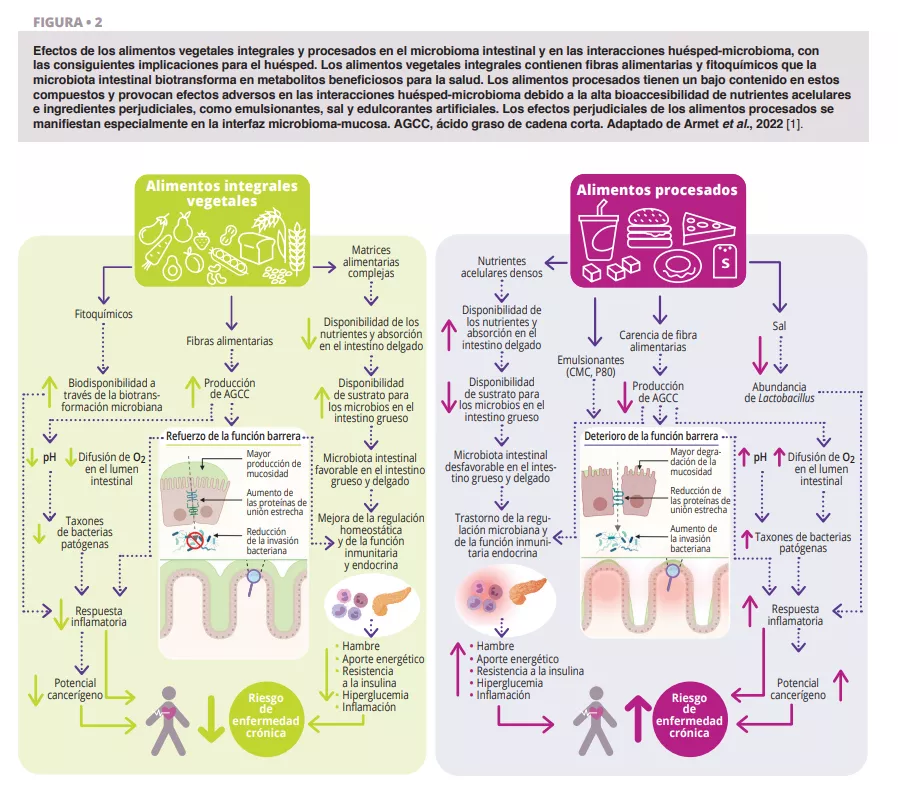
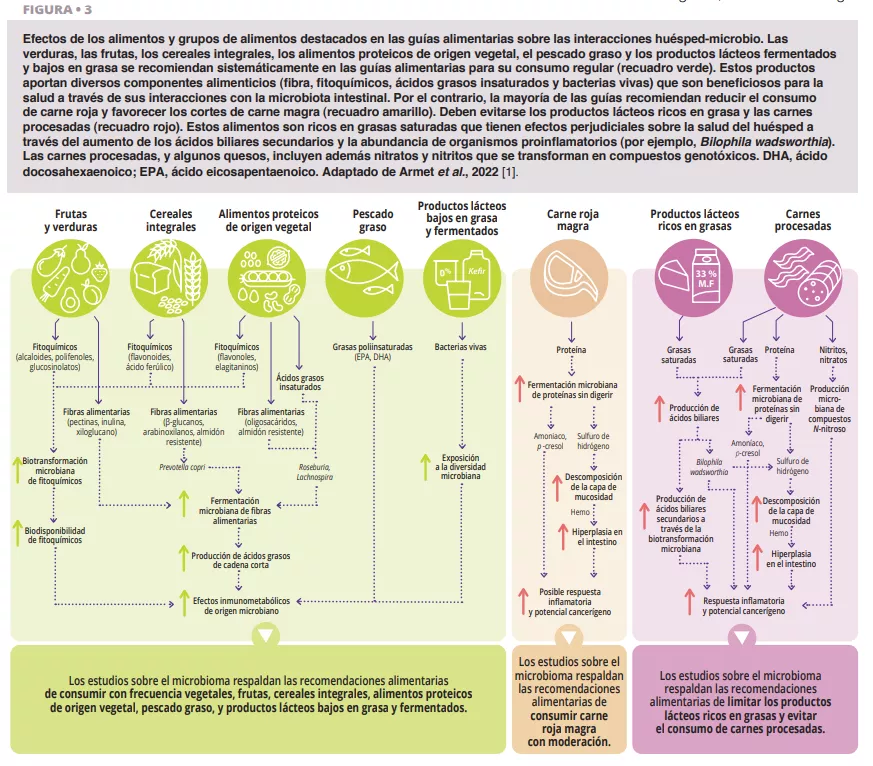
Microbiota vaginal #20
Por la Prof. Satu Pekkala
Academy of Finland Research Fellow, Faculty of Sport and Health Sciences, University of Jyväskylä, Finland
21% What women know (and don't know) about their vaginal microbiota
Aborto espontáneo recurrente: estudio de un caso de trasplante de microbiota vaginal (TMV)
Este caso tiene un claro interés científico. Una mujer con antecedentes de abortos tardíos y disbiosis vaginal grave se somete a un trasplante de microbiota vaginal (TMV). Cinco meses después, se queda embarazada, con una flora vaginal sana, y posteriormente da a luz a un bebé a término. Sin embargo, hay que tener en cuenta las limitaciones del estudio: se trataba de una única paciente diagnosticada con síndrome de anticuerpos antifosfolípidos (APLS, una trombofilia asociada a abortos espontáneos). Además, la terapia recibida en este caso de APLS durante su último embarazo puede explicar los resultados en parte o en su totalidad.
Antes del trasplante, esta mujer de 30 años, madre de un hijo, había sufrido una serie de abortos espontáneos, algunos de ellos tardíos (en la semana gestacional 27 en 2019, y en las semanas 17 y 23 en 2020). Durante los nueve años anteriores, se había quejado de picores y flujo vaginal, que empeoraron durante sus intentos de embarazo, a pesar del tratamiento. Y tenía razón ya que, en julio de 2021, su microbiota vaginal mostraba una disbiosis muy fuerte, con una dominancia del 91,3 % de Gardnerella spp. De acuerdo con un protocolo de uso compasivo, en septiembre de 2021 se realizó un TMV de una donante sana, el día 10 de su ciclo menstrual, sin pretratamiento antibiótico. Mientras que los antibióticos administrados por vía oral o vaginal (metronidazol o clindamicina) pueden tener una tasa de curación de la disbiosis vaginal del 80 %-90 % un mes después del tratamiento, la tasa de recaída puede ser de hasta el 60 % tras un año, con el riesgo añadido de resistencia. El TMV corrigió rápidamente la disbiosis y sus síntomas y, durante varios meses, las cepas de Lactobacillus similares a las de la donante se volvieron dominantes. En febrero de 2022, la paciente se quedó embarazada de forma natural. Recibió tratamiento para su APLS durante el embarazo1. El seguimiento regular de su microbiota vaginal reveló la reaparición de Gardnerella spp. (41,8 %) en la sexta semana de gestación. Inicialmente, se planificó un segundo TMV para dos semanas más tarde, pero para el día en cuestión, L. crispatus había vuelto a dominar la microbiota de la paciente. Al final del embarazo, nació un niño perfectamente sano por cesárea programada. Aunque estos resultados deben confirmarse con otros estudios clínicos, sugieren que el TMV puede servir como tratamiento para pacientes con disbiosis vaginal grave, incluidas las que corren riesgo de complicaciones tras la fecundación in vitro. Para los autores, este estudio de caso sirve como prueba de concepto, pero también ofrece esperanzas para terapias basadas en la modulación de la microbiota vaginal.