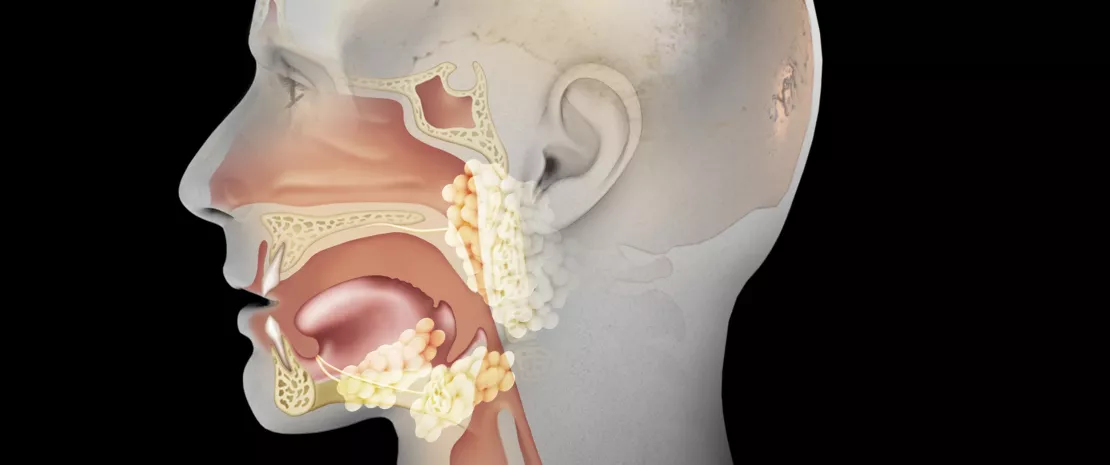
To, co jest powszechnie określane jako „mikrobiota okolic uszu, nosa i gardła”, w rzeczywistości składa się nie z jednej, ale z kilku mikrobiot. Antybiotyki działają najczęściej na poszczególne mikrobioty, a zakres ich działania rozciąga się od jamy ustnej do gardła, wnętrza zatok, a nawet do ucha środkowego. Niniejszy rozdział poświęcony jest głównie wpływowi antybiotyków na mikrobiotę górnych dróg oddechowych. To idealny przypadek podręcznikowy: mikrobiota górnych dróg oddechowych wydaje się być jedną z głównych barier ochronnych uszu, podczas gdy antybiotyki przepisywane w leczeniu uszu, zwłaszcza w przypadkach ostrego zapalenia ucha środkowego, są dla niej ogromnym zagrożeniem.
Mikrobiota górnych dróg Oddechowych sprzymierzeńcem Zdrowia uszu?
Mikrobiota górnych dróg oddechowych jest kolonizowana bezpośrednio po urodzeniu przez różne komensale (Dolosigranulum Corynebacterium, Staphylococcus, Moraxella, Streptococcus). Coraz więcej wskazuje na to, że większa względna obfitość gatunków komensalnych (Dolosigranulum spp. i Corynebacterium spp.), jak również większa różnorodność mikrobioty nosowo-gardłowej1 są związane z mniejszą częstością kolonizacji górnych dróg oddechowych przez Streptococcus pneumoniae, Haemophilus influenzae i Moraxella catarrhalis2,3, czyli przez trzy otopatogeny związane z ostrym zapaleniem ucha środkowego (OZUŚ).
Antybiotykoterapia: duże ryzyko, małe korzyści
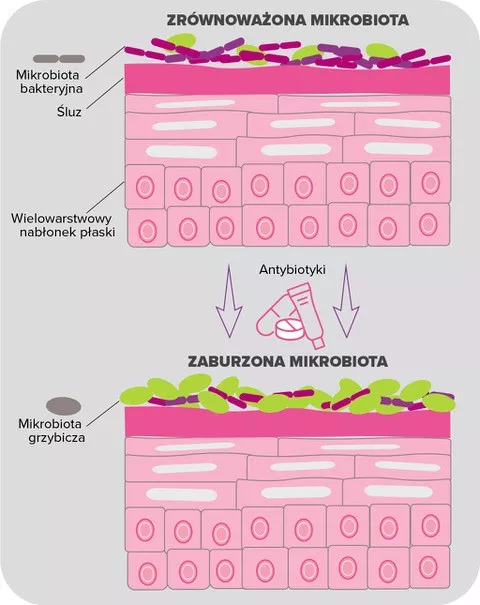
Ekspozycja na działanie antybiotyków wpływa na mikrobiotę górnych dróg oddechowych, zmniejszając liczebność gatunków ochronnych i zwiększając liczebność bakterii gram-ujemnych (Burkholderia spp., Enterobacteriaceae, Comamonadaceae,Bradyrhizobiaceae)4,5, a także S. pneumoniae, H. influenzae i M. catarrhalis5. W wyniku nabycia oporności na środki przeciwdrobnoustrojowe te bakterie, które w innym przypadku nie mogłyby skutecznie rozwijać się w danej niszy, mają możliwość namnażania się podczas leczenia do tego stopnia, że mogą stać się patogenne6. Ponadto uważa się, że antybiotyki nie przynoszą żadnych korzyści w większości przypadków dziecięcego ostrego zapalenia ucha środkowego (OZUŚ) (główny powód przepisywania antybiotyków dzieciom7) i innych infekcji górnych dróg oddechowych (ból gardła lub przeziębienie)7,8, ze względu na często niebakteryjny charakter tych schorzeń: od 60% do 90% dzieci z OZUŚ wraca do zdrowia bez antybiotyków9,10. Wreszcie, antybiotyki prowadzą również do dysbiozy mikrobioty jelitowej, która może powodować różnego rodzaju skutki uboczne, takie jak biegunka związana z antybiotykoterapią3,11 (patrz strona 4 dotycząca mikrobioty jelitowej).

 Ekspozycja na antybiotyki w wieku 0–6 lat szkodzi mikrobiocie jelit i rozwojowi dziecka
Ekspozycja na antybiotyki w wieku 0–6 lat szkodzi mikrobiocie jelit i rozwojowi dziecka
 Oporność na antybiotyki: mikrobiota na pierwszym planie
Oporność na antybiotyki: mikrobiota na pierwszym planie