Doradzanie pacjentowi, aby „przyjmował probiotyki”, może nie wystarczyć w przypadku chorego, który potrzebuje produktu probiotycznego, aby zaradzić konkretnemu problemowi 3. A jednak amerykańskie badanie pokazuje, że 40% pracowników podstawowej opieki zdrowotnej, którzy zalecają probiotyki swoim pacjentom, pozwala im wybrać dowolny produkt 4. Chociaż obecnie przyjmuje się, że probiotyki ogólnie przyczyniają się do dobrego stanu mikrobioty jelitowej, eksperci są zgodni co do tego, że skuteczność działania probiotyków zależy od szczepu 5,6.
Dlatego ważne jest prawidłowe dopasowanie szczepu do określonych potrzeb zdrowotnych lub konkretnej choroby 7. W tym celu konieczne jest w szczególności sprawdzenie, czy cechy i informacje o produkcie (szczep, dawkowanie, skład) odpowiadają pod każdym względem cechom produktu użytego w badaniach klinicznych, które wykazały korzyści płynące z jego stosowania . Należy również zwrócić szczególną uwagę na następujące informacje :
- jasne wskazanie rodzaju, gatunku i szczepu probiotyku zawartego w produkcie oraz przypisanego mu wskazania do stosowania 8,9 ;
- dawkowanie produktu 3,8 ;
- dowody kliniczne skuteczności szczepu probiotycznego w tym obszarze terapeutycznym, z którym jest powiązany, w dawce podobnej i nie niższej niż stosowana w badaniach klinicznych 8.
Przy wyborze produktu probiotycznego należy wziąć pod uwagę także inne czynniki :
- rodzaj preparatu 3,;
- okres trwałości do daty ważności, a nie od daty produkcji ;
- jakość produktu powiązaną z wymaganiami producenta: wyniki kontroli jakości i najlepiej certyfikację przez niezależny organ 8, .
Do wiadomości pacjenta
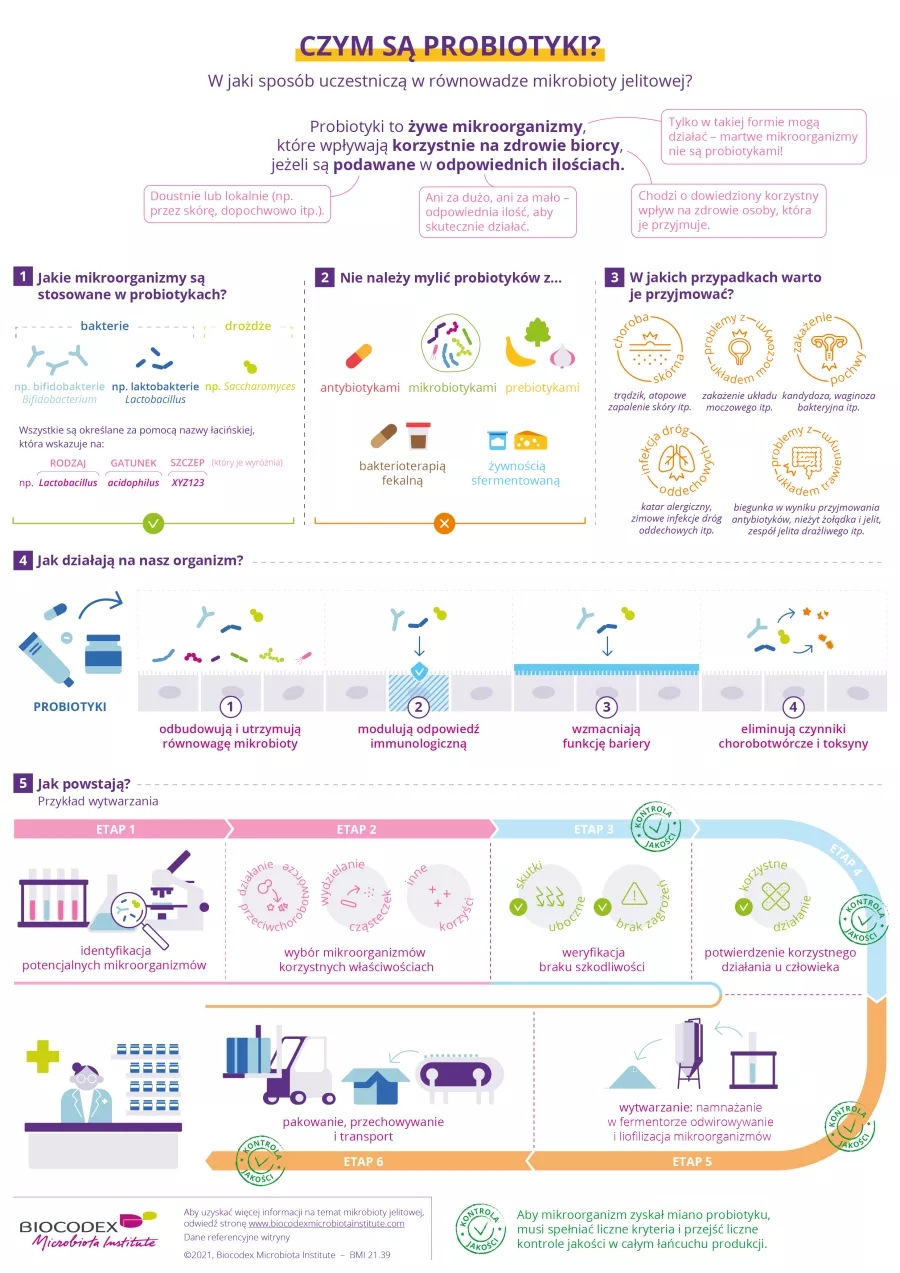
Poniżej znajduje się infografika „Czym są probiotyki?” przeznaczona dla Twojego pacjenta, informująca go o produktach na bazie probiotyków i ułatwiająca dyskusję podczas konsultacji.
Biocodex Microbiota Institute rekomenduje stronę internetową ISAPP, która zapewnia zarówno pracownikom służby zdrowia, jak i konsumentom materiały na temat probiotyków (w języku angielskim): https://isappscience.org/for-clinicians/resources/
Potwierdzone klinicznie informacje w zakresie gastroenterologii dotyczące wskazań u dorosłych i dzieci znajdziesz na stronach World Gastroenterology Organisation (WGO) i American Gastroenterological Association (AGA).