Pele
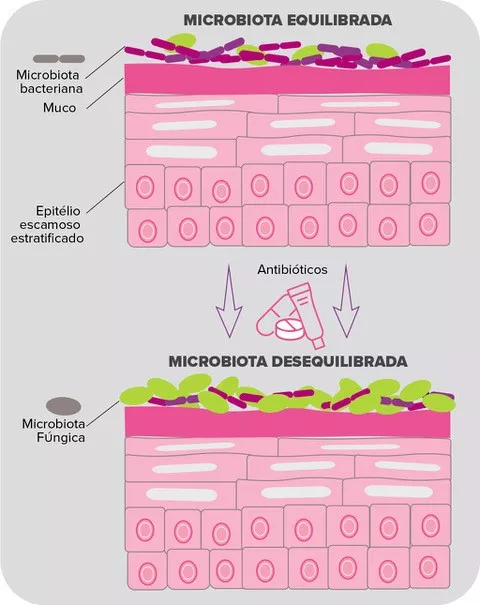
Por muito tempo considerada principalmente como uma fonte de infeção, a microbiota da pele humana é hoje comumente aceite como um fator importante de saúde e bem-estar1. Ao promover respostas imunológicas e defesa, desempenha um papel fundamental na reparação dos tecidos e funções de barreira, inibindo a colonização ou infeção por patogénicos oportunistas2.
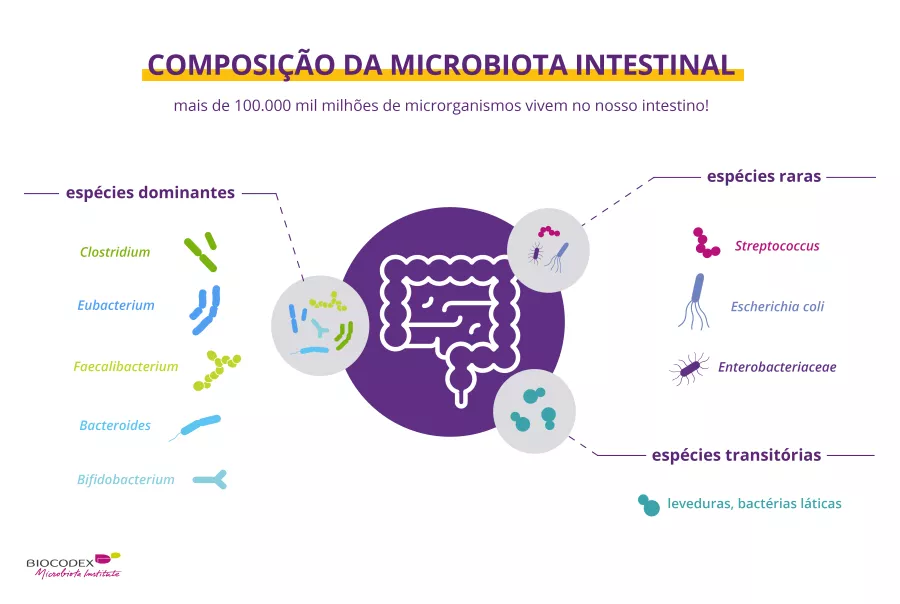
Para cada área de peke, uma microbiota próprio
A microbiota da pele abriga milhões de bactérias, bem como fungos e vírus em menos quantidades. Corynebacterium, Cutibacterium (anteriormente conhecido como Propionibacterium), Staphylococcus, Micrococcus, Actinomyces, Streptococcus e Prevotella são os géneros mais comuns de bactérias encontrados na pele humana3. No entanto, a abundância relativa de taxa bacteriana depende muito do microambiente local da área específica da pele e, principalmente, das suas características fisiológicas, isto é, se é sebácea, húmida ou seca. Portanto, as espécies de Cutibacterium lipofílicas dominam nas áreas sebáceas, enquanto as espécies de Staphylococcus e Corynebacterium são particularmente abundantes em áreas húmidas4.
Da fisiologia à patologia, o papel ambivalente de C. acnes
O anaeróbio aerotolerante C. acnes é uma das espécies bacterianas mais abundantes no microbioma da pele. Tem sido implicada no acne, como uma doença inflamatória crónica da pele com patogénese complexa5. Em contraste com a observação anterior, estudos recentes indicam que a hiperproliferação de C. acnes não é o único fator implicado no desenvolvimento do acne6. Na verdade, uma perda de equilíbrio entre as diferentes estirpes de C. acnes, juntamente com uma disbiose da microbiota da pele, desencadeia a acne6. Além disso, as interações entre S. epidermidis e C. acnes são de importância crítica na regulação da homeostase da pele: S. epidermidis inibe o crescimento de C. acnes e a inflamação da pele. Por sua vez, C. acnes, ao segregar ácido propiónico que participa, entre outras coisas, na manutenção do pH ácido do folículo pilossebáceo, inibe o desenvolvimento de S. epidermidis. Acredita-se que a Malassezia, o fungo cutâneo mais abundante, também desempenhe um papel no acne refratário ao recrutar células do sistema imunológico, embora este dado precise ser mais explorado6.
Tratamento do acne, uma importante fonte de resistência aos antibióticos
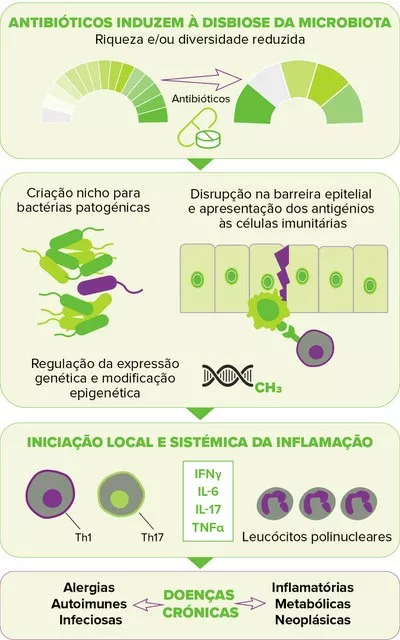
Apesar de serem usados rotineiramente no tratamento do acne os antibióticos tópicos e orais têm-se demonstrado prejudiciais. Uma das grandes preocupações expressa pelos especialistas é o desiquilíbrio da microbiota da pele, embora ainda existam poucos dados precisos sobre o assunto. Nesse sentido, um estudo longitudinal recente comparou a microbiota da face de 20 doentes com acne, antes e depois de seis semanas de terapia com doxiciclina oral. Curiosamente, a exposição a antibióticos foi associada a um aumento na diversidade bacteriana; Segundo os autores, isso pode ser devido a uma diminuição da colonização por C. acnes, que permite o crescimento de outras bactérias7.
No entanto, a preocupação mais significativa com o uso de antibióticos para o tratamento do acne diz respeito à resistência bacteriana.. Observada pela primeira vez na década de 1970, é sem dúvida uma preocupação na dermatologia desde os anos 19808. A resistência a C. acnes é de longe a mais documentada: os dados mais recentes apontam para taxas de resistência que atingem mais de 50% para eritromicina em alguns países, 82-100% para azitromicina e 90% para clindamicina. Quanto às tetraciclinas, embora ainda sejam bastante eficazes contra a maioria das estirpes de C. acnes, as taxas de resistência estão a aumentar variando de 2% a 30% consoante a região geográfica do planeta9. A resistência aos antibióticos não se limita a C. acnes; embora os antibióticos tópicos usados por doentes com acne (especialmente como monoterapia) tenham demonstrado aumentar o surgimento de bactérias resistentes da pele, como S. epidermidis, os antibióticos orais estão associados ao aumento da emergência de S. pyogenes orofaríngeo resistente a antibióticos8,10. Além disso, taxas do aumento de infeções do trato respiratório superior e de faringite estão descritos e associadas ao aumento do uso dos antibiótico do acne11,12.
Recomendação de uso limitado de antibióticos contra o acne
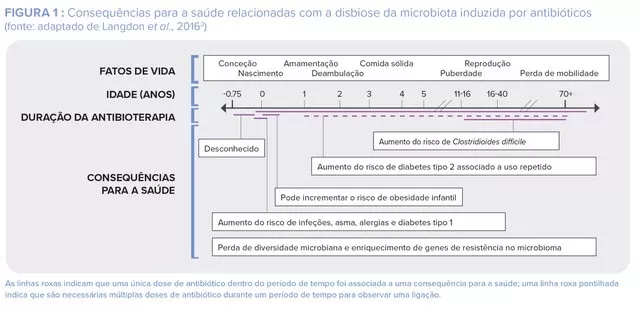
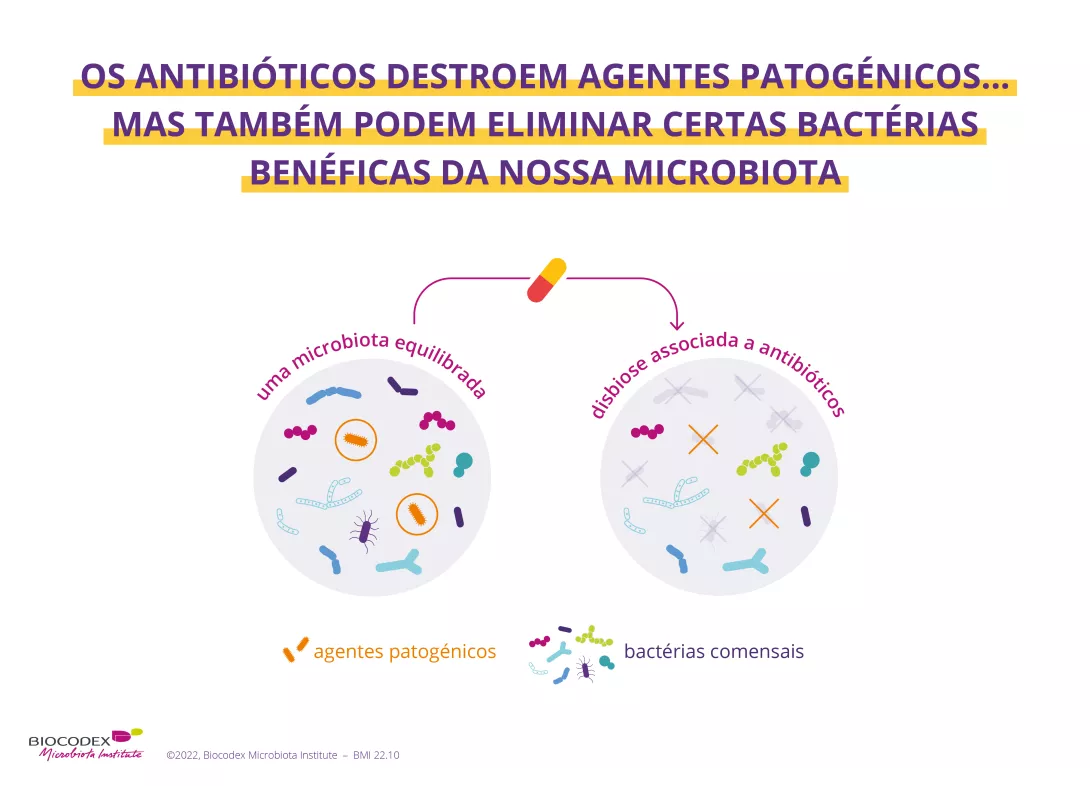
Facto é que, os níveis de prescrição de antibióticos para o acne permanecem elevados e por períodos mais longos do que os recomendados nas diretivas13. Neste contexto de crescentes preocupações os especialistas apelam para um uso mais limitado de antibióticos no tratamento do acne13. Em particular, foi proposta uma estratégia a este respeito pela aliança global para melhorar os resultados contra o acne (ver figura abaixo).
 Exposição aos antibióticos entre os 0 e os 6 anos: microbiota intestinal alterada, desenvolvimento da criança perturbado
Exposição aos antibióticos entre os 0 e os 6 anos: microbiota intestinal alterada, desenvolvimento da criança perturbado
 Uma nova geração de agentes antibacterianos? Um plasmídio capaz de matar bactérias patogénicas
Uma nova geração de agentes antibacterianos? Um plasmídio capaz de matar bactérias patogénicas